Las evidencias científicas sugieren un posible efecto protector de los polifenoles del vino frente a los trastornos neurodegenerativos que provoca la enfermedad de Alzheimer (EA), aunque se desconocen los mecanismos y, hasta el momento, los estudios para evaluar de forma exhaustiva el efecto del vino sobre la etiopatogenia de la EA son muy escasos. El objetivo principal de la investigación que a continuación publicamos, realizada por científicos españoles de varias universidades y del Instituto de Ciencias de la Vid y el Vino (ICVV) de España, es entender cómo la dieta, y especialmente los polifenoles presentes en el vino y otros alimentos vegetales, así como diversos factores del estilo de vida, interactúan con el microbioma oral e intestinal, en relación con la salud digestiva y el deterioro cognitivo.

La enfermedad de Alzheimer (EA) es la forma más común de demencia y tiene una elevada morbilidad y mortalidad. La EA se caracteriza principalmente por la presencia de dos estructuras aberrantes en el cerebro de los pacientes, placas seniles formadas por péptido-β-amiloide (Aβ) y ovillos neurofibrilares cuyo principal componente es la proteína tau fosforilada.
Aunque actualmente no se conoce bien la etiopatogenia, cada vez son más los estudios que demuestran un efecto causal del microbioma intestinal sobre la EA y las funciones cognitivas, a través del «eje microbiota intestino-cerebro».
Para ello, se está llevando a cabo una aproximación experimental que tiene como finalidad evaluar el posible efecto protector de los polifenoles del vino, mediante la suplementación de la dieta en dos modelos murinos de la EA (patología Aß y Tau), y, por otro lado, se está profundizando en el estudio de los mecanismos de protección mediante la evaluación de los efectos del ácido protocatéquico sobre la actividad eléctrica del cerebro.
Introducción
El cerebro humano contiene cerca de 100.000 millones de neuronas que se conectan entre sí a través de sinapsis, permitiendo la comunicación entre diferentes partes del cerebro, y también del cerebro con los músculos y los diferentes órganos del cuerpo. Esta comunicación es vital para el correcto funcionamiento de nuestro cerebro, pero también del organismo, permitiendo realizar funciones básicas como respirar, caminar, pensar y hablar.
Las enfermedades neurodegenerativas provocan la pérdida progresiva e irreparable de neuronas, lo que conlleva alteraciones en las funciones para las que estas neuronas son básicas. Entre las enfermedades neurodegenerativas destaca la enfermedad de Alzheimer (EA), reconocida como la forma más común de demencia y principal causa de dependencia en los adultos mayores, así como la quinta causa de muerte en todo el mundo. El Alzheimer es una enfermedad multifactorial que se ha asociado a varios factores de riesgo, como la edad avanzada, factores genéticos, ambientales y relacionados con el estilo de vida, que aumentan las probabilidades de padecer EA.
Las alteraciones del estado del microbioma, especialmente el intestinal, se asocian cada vez más con la incidencia de trastornos cognitivos y neuroinflamación en pacientes con enfermedad de Alzheimer (EA). Por tanto, existe un gran interés en la comprensión de cómo la microbiota regula la comunicación bidireccional entre el intestino y el cerebro como fundamento de las intervenciones basadas en el microbioma.
La dieta se considera el principal factor modificable de las comunidades microbianas y, entre los componentes de la dieta, las investigaciones actuales sugieren que los compuestos fenólicos o polifenoles de la dieta tienen un alto potencial de modulación del microbioma, así como la fisiología y función cerebral.
El vino es uno de los componentes más característicos de la dieta mediterránea. En particular, el vino tinto, tanto por su contenido en polifenoles como por la diversidad de estructuras fenólicas, es uno de los alimentos que ha demostrado efectos beneficiosos para la salud. Por otro lado, los patrones de consumo de vino y, específicamente, el consumo regular y moderado de vino frente a otras bebidas alcohólicas, dentro de un estilo de vida saludable, podría contribuir a un envejecimiento con bienestar y calidad de vida. De hecho, son conocidas las acciones neuroprotectoras, antioxidantes y antinflamatorias de los polifenoles del vino, y, recientemente, se ha sugerido un posible efecto protector del consumo de vino sobre el desarrollo del deterioro cognitivo. Sin embargo, no se conoce cómo puede afectar la presencia de etanol, ni los mecanismos que subyacen a los potenciales efectos del consumo moderado de vino en el desarrollo y fisiopatología de la EA.
El objetivo general de estas investigaciones actuales es evaluar si el consumo moderado de vino en el contexto de la dieta tiene un efecto protector en las primeras fases de la EA o del deterioro cognitivo leve, como estrategia para ralentizar o incluso minimizar el deterioro cognitivo. El estudio también pretende evaluar el impacto del consumo de vino sobre la microbiota intestinal y el metabolismo microbiano.
Para ello, se siguen dos aproximaciones: 1) un enfoque integral del efecto de la alimentación con vino/vino desalcoholizado en dos modelos de ratones «transgénicos» (APP/PS1 y P301S) que desarrollan las dos principales lesiones (placas de β-amiloide y ovillos de tau, respectivamente) responsables de la aparición de la EA en humanos, y 2) un enfoque dirigido a la actividad electrofisiológica del hipocampo y el córtex en respuesta a la administración local de metabolitos derivados de los polifenoles del vino.
Intervención dietética con vino y vino desalcoholizado
Se ha realizado un diseño experimental que incluye tanto ratones «transgénicos» de ambos modelos (APP/PS1 y P301S9) como ratones control (wild-type) en grupos de 24 animales (50% machos y hembras). En concreto, los grupos experimentales fueron los siguientes: grupo 1, ratones wild-type con una dieta estándar y agua de bebida; grupo 2, transgénicos con una dieta estándar y agua de bebida; grupo 3, transgénicos con una dieta estándar y vino (1 mL/día, equivalente a un consumo diario moderado de 200 mL de vino en humanos); grupo 4, transgénicos con dieta estándar y vino desalcoholizado (1 mL/día, equivalente a una dosis diaria de 200 mL vino en humanos); grupo 5, transgénicos con dieta estándar y vino desalcoholizado (2 mL/día, equivalente a dosis diaria de 400 mL vino en humanos). La comparación entre los grupos 4 y 5 permite realizar un estudio dosis/respuesta, y entre los grupos 3 y 4, establecer el efecto del alcohol.
La suplementación con vino/vino desalcoholizado se ha llevado a cabo en el agua de bebida, controlando el volumen ingerido por los animales, empezando a los 2 meses de edad del animal y durante los 6 meses, para mimetizar un consumo de vino regular y continuado en humanos. El modelo APP/PS1 desarrolla depósitos beta-amiloide en el cerebro entre los 6 -7 meses de edad y el P301S desarrolla ovillos neurofibrilares a partir de los 9 meses de edad, por lo que la suplementación de la dieta con vino pretende llevar a cabo esta intervención con fines preventivos frente a la EA.
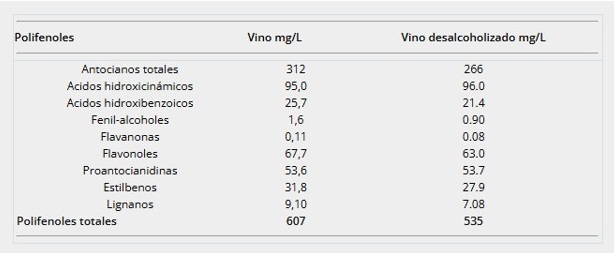
El vino se ha elaborado para el estudio en la bodega experimental del ICVV (La Rioja, España) a partir de las variedades de uva tinta Tempranillo y Graciano. La composición fenólica del vino se ha caracterizado mediante cromatografía líquida de alta resolución acoplada a espectrometría de masas (UHPLC/QqQ-MS/MS). El vino desalcoholizado se ha obtenido a partir del mismo vino sometido a un proceso de secado, mediante liofilización, y posterior reconstitución hasta el volumen original con agua destilada. En la Tabla 1 se presenta la concentración media de los diferentes grupos de compuestos fenólicos en el vino y el mismo vino desalcoholizado.
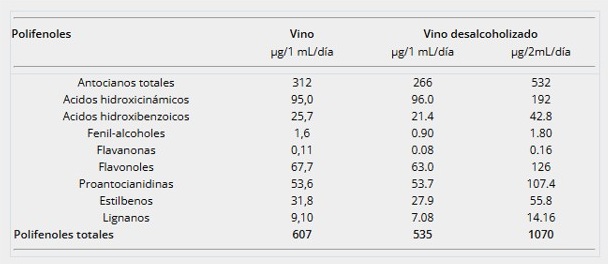
A partir de los datos de contenido fenólico se ha calculado la dosis diaria y naturaleza de los compuestos fenólicos aportados por el vino, con el objetivo de establecer una asociación entre los compuestos bioactivos ingeridos y los efectos fisiológicos y patológicos que pudieran observarse durante la intervención. En la Tabla 2 se presenta la equivalencia de las cantidades de polifenoles ingeridas diariamente.
Para verificar el consumo de vino durante el período de suplementación de la dieta con vino, se han tomado muestras de orina al inicio de la suplementación (2 meses) y en el momento del sacrificio (9 meses). Los metabolitos fenólicos se han analizado mediante (UHPLC/QqQ-MS/MS). Los resultados del estudio de metabolómica dirigida en orina ha mostrado un gran número de metabolitos de Fase I y II. además de derivados de fermentación colónica derivados de los polifenoles ingeridos diariamente a través del vino. De todos ellos se han seleccionado como biomarcadores claros de la ingesta de polifenoles de vino los derivados del metabolismo de antocianos y estilbenos (Figs. 1A y 1B. respectivamente) que no se detectaron en las muestras recogidas al inicio de la suplementación y en los grupos 1 y 2 (control).
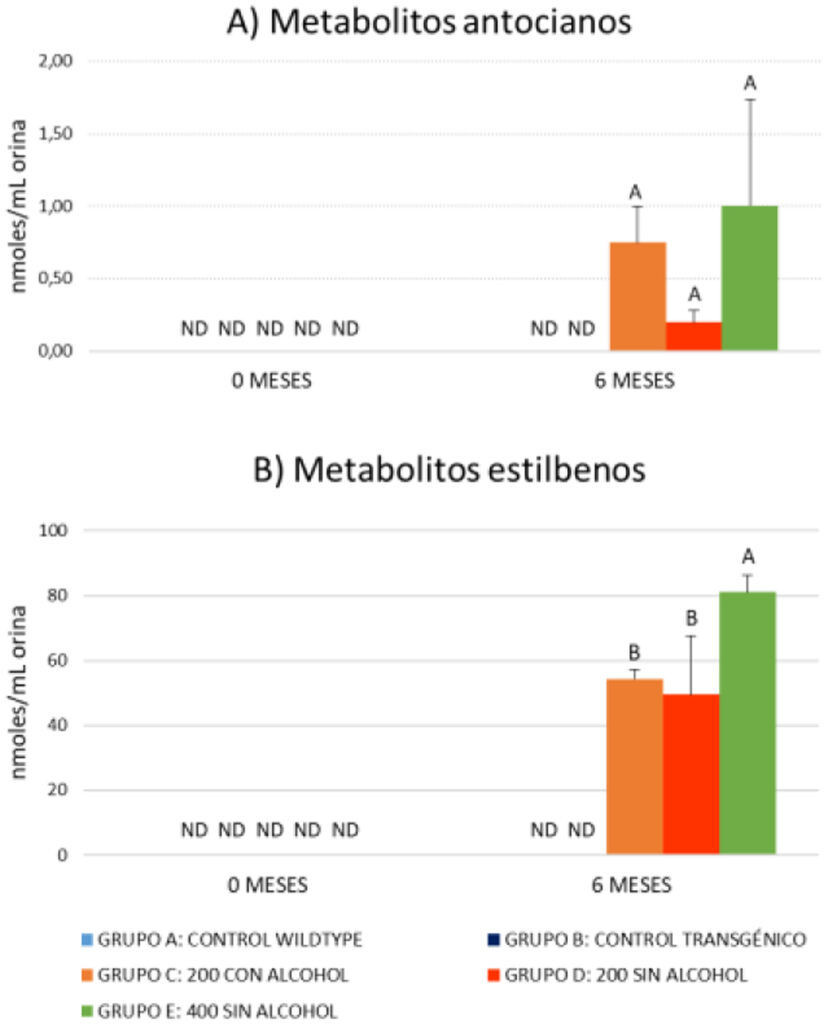
Los datos se expresan como valores medios ± SD. Letras diferentes indican diferencias entre grupos (Modelo Lineal General y ANOVA unidireccional, p < 0,05). ND: no detectado.
Se han tomado muestras fecales al inicio del experimento, a mitad del mismo (tras 3 meses de suplementación con vino) y al final del período experimental. Además, tras 3 meses de suplementación con vino y al finalizar el período experimental (tras 6 meses de intervención), se sacrificaron los animales para la recolección de sangre y orina, así como cerebro, intestino e hígado. Una semana antes del sacrificio se realizaron las pruebas de comportamiento (test de reconocimiento de objetos y/o de miedo condicionado) para valorar la afectación de la memoria a corto y largo plazo.
En las muestras fecales se están llevando a cabo el análisis de la composición de la microbiota intestinal mediante secuenciación del gen ARNr 16S (MiSeq. 2x 300 pb. paired-end). Los ácidos grasos de cadena corta se están analizando mediante GC-MS en muestras de sangre y heces. En las muestras de cerebro recogidas al inicio del experimento y tras los 3 y 6 meses de suplementación con vino/vino desalcoholizado se están llevando a cabo análisis histológicos y moleculares para cuantificar los niveles de placas de beta-amiloide y p-TAU, respectivamente. El análisis conjunto de todos estos resultados, se espera que contribuya a una evaluación integral de los efectos del consumo de vino y vino desalcoholizado en la incidencia de EA en los dos modelos murinos.
Por otro lado, y con el fin de evaluar el efecto del consumo de vino en el metaboloma de los animales, se ha analizado el perfil de metabolitos fenólicos presentes en el agua fecal de las heces de ratones control y transgénicos suplementados, con y sin vino desalcoholizado, mediante UPLC-MS [11]. Estos resultados están siendo analizados actualmente, pero los primeros datos muestran que hay un cambio en el metaboloma fecal, tanto para el modelo de taupatía como para el control, tras tres meses de la intervención con vino.
Estudio del efecto del PCA sobre la actividad eléctrica del cerebro
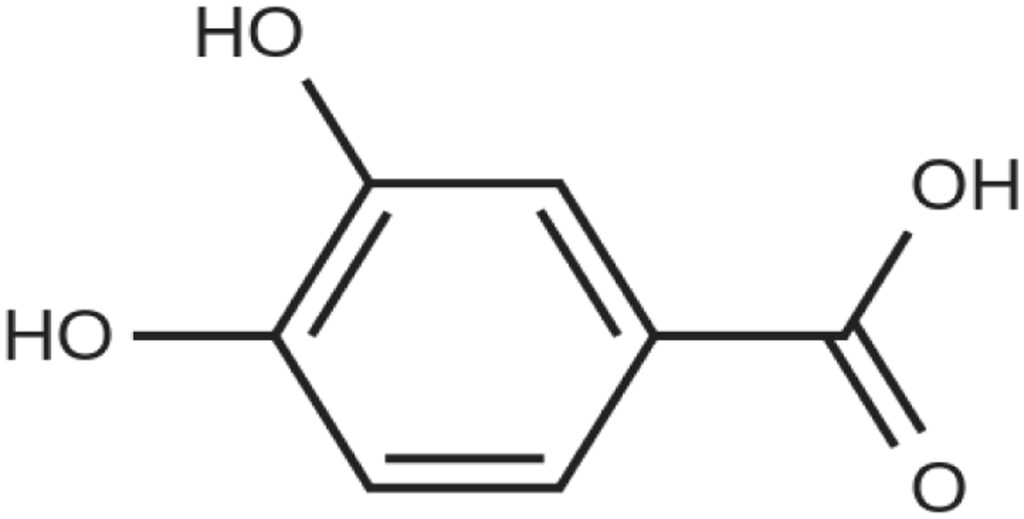
En este experimento se exploran los efectos sistémicos y directos de los metabolitos fenólicos del vino, como el ácido protocatéquico (PCA) (Fig. 2). en la actividad electrofisiológica del hipocampo y del córtex de ratas sana, como mecanismo potencial de los polifenoles sobre las redes eléctricas cerebrales implicadas en enfermedades neurodegenerativas.
Para este estudio electrofisiológico, se han empleado 26 ratas Sprague-Dawley (250-300 gr) de entre 11 y 12 semanas de edad que se alojaron en condiciones higiénicas, con ciclos de luz/oscuridad de 12 horas, temperatura estable (20-22 ºC) y comida y bebida ad libitum de acuerdo con la normativa europea vigente (2010/63/UE), el Comité de Ética del CSIC (27/07/2016) y el Área de Protección Animal de la Consejería de Medio Ambiente de la Comunidad de Madrid (26/10/2016).
De estos 26 animales, 16 fueron utilizados para la realización de los experimentos electrofisiológicos que se detallarán a continuación, y los otros 10 únicamente para llevar a cabo los test conductuales que permitan estudiar su relación con la memoria.
Se realizaron tres tipos de experimentos electrofisiológicos que permitieron conocer el efecto de este ácido sobre los potenciales provocados y espontáneos de la región de CA1 del hipocampo tras la estimulación de la región de CA3, o de la propia región de CA1 de manera antidrómica.
En el primer experimento, el PCA se inyectó de manera intraperitoneal, y se siguió el siguiente protocolo: inicialmente se realizaron 3 minutos de registro sin llevar cabo ninguna inyección (grupo control), posteriormente se hicieron 30 minutos de registro tras la inyección intraperitoneal de NaCl 0.9% con 1% de DMSO (grupo DMSO), y finalmente se registró durante 40 minutos después de la inyección intraperitoneal de 150 mg/kg de PCA diluido en solución de NaCl 0.9% con 1% de DMSO (grupo PCA).
En los dos siguientes experimentos, la inyección fue intracerebral, y se siguió un protocolo ligeramente distinto. Inicialmente, se registró en la región CA1 sin llevar a cabo ninguna inyección, para obtener los potenciales provocados en condiciones normales (grupo control de ACSF). A continuación, se registraron durante 15 minutos los efectos de la inyección de ACSF (Artificial CerebroSpinal fluid) con 1% de DMSO, ya que el PCA se inyectó posteriormente diluido en esta mezcla (este sería el grupo ACSF). Después de esto, se cambió la micropipeta por una rellena de PCA (15mg/kg) solubilizado en ACSF con 1% de DMSO y se movió ligeramente en el eje antero-posterior para inyectar en una región diferente a la que se inyecto el ACSF y así observar claramente los efectos de este PCA.
Al igual que en el caso anterior, primero se registró durante 3 minutos sin inyectar ninguna sustancia (grupo control de PCA) y por último se registró durante 40 minutos después de la inyección de una microgota de PCA en la región CA1 (grupo PCA).
Como principales resultados del primer experimento, la Fig. 3 muestra los efectos tras la administración intraperitoneal de PCA sobre los potenciales provocados que se generan en CA1 al estimular la región de CA3, así como sobre los potenciales espontáneos, generados sin necesidad de que haya una estimulación. En este caso, los resultados muestran que el DMSO no produjo ningún efecto significativo sobre el potencial postsináptico excitatorio (fEPSP) o el potencial sináptico ortodrómico (o-PS). Sin embargo. el PCA aumentó significativamente ambos potenciales (expresados como el % respecto al control 3 minutos después de la inyección) (Fig. 1A y 1B).
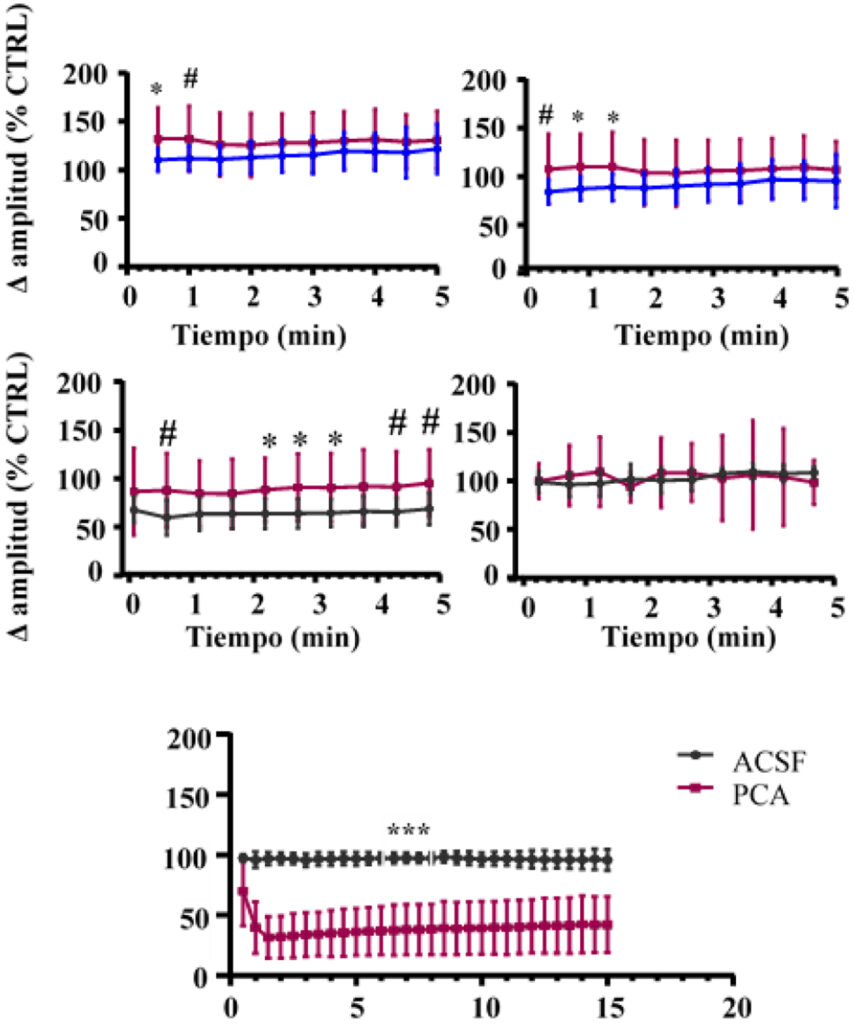
Estos hallazgos son compatibles con un aumento de la espiga poblacional en CA1 que sigue al de la respuesta sináptica. Sin embargo, dado que el PCA atraviesa la barrera hematoencefálica, su efecto sobre la excitabilidad del hipocampo puede tener múltiples influencias y llegar a través de diferentes vías. Por tanto, se investigó si el PCA tenía algún efecto directo sobre la actividad electrogénica de esta población neuronal. En este caso, los resultados muestran que la microinyección de PCA no afectó significativamente a los o-PS (Fig. 3C) en relación con los valores previos a la inyección, y tampoco variaron los fEPSP (Fig. 3D).
Tras evaluar los efectos de la inyección local de PCA, se realizó un experimento para determinar si estos efectos se debían a una implicación de los canales de sodio [12]. Para ello, se evaluó la respuesta de CA1 mediante la estimulación antidrómica de las proyecciones de esta región.
En este caso, los resultados muestran que el potencial sináptico antidrómico (a-PS) no se vio afectado por la inyección de vehículo, sin embargo el PCA causó un rápido y fuerte descenso en el a-PS. Este efecto persistió y apenas se había recuperado 40 minutos después de la inyección. La ausencia de efecto sobre la o-PS indica que las neuronas siguen siendo eléctricamente viables tras la administración de PCA y que todavía pueden producir espigas de avance sinápticas (dendrita a soma). Por el contrario, la fuerte reducción de la a-PS sugiere una disfunción de la zona generadora de espigas en la unión axón-soma (Fig. 3E).
Conclusiones y perspectivas
Se ha ejecutado adecuadamente el estudio de los efectos del consumo moderado de vino y vino desalcoholizado en los modelos murinos APP/PS1 y P301S que desarrollan las dos principales lesiones de la EA (placas de β-amiloide y ovillos de tau, respectivamente).
Los primeros resultados de biomarcadores fenólicos en orina y heces parecen confirmar la ingesta efectiva de vino por parte de los animales, por lo que es de esperar que se observen efectos en la fisiolopatología de la EA derivados de su consumo.
En los próximos meses se espera que el estudio de correlaciones entre el metagenoma intestinal y el metaboloma en los dos modelos animales contribuya a discernir los efectos del consumo de vino y sus polifenoles sobre los dos principales factores que desencadenan la EA (placas β-amiloide y ovillos Tau) de forma integrada.
Por otro lado, se ha constatado que el ácido protocatéquico, metabolito microbiano derivado de los polifenoles del vino, muestra efectos sistémicos y directos en la actividad electrofisiológica del hipocampo y el córtex de ratas sanas, lo que podría considerarse como posible mecanismo de acción de los polifenoles sobre las redes eléctricas cerebrales implicadas en enfermedades neurodegenerativas.
Fuente: https://www.bio-conferences.org Investigación presentada en el 44 Congreso de la Organización Internacional de la Vid y el Vino (OIV)
Autores: Marta Montero1, P. Pérez-Matute2, S. Yuste3,4, M. Íñiguez2, E. Recio-Fernández2, M-J. Motilva3, G. Leon-Espinosa5,6,7, O. Herreras8, B. Bartolomé1, M. V. Moreno-Arribas1
1 Instituto de Investigación en Ciencias de la Alimentación, CIAL (CSIC-UAM) 28049 Madrid, España
2 Unidad de Enfermedades Infecciosas, Microbiota y Metabolismo, Centro de Investigación Biomédica de La Rioja (CIBIR), Unidad asociada de I+D+i del CSIC. 26006 Logroño (La Rioja), España
3 Instituto de Ciencias de la Vid y el Vino (ICVV), CSIC-Universidad de La Rioja-Gobierno de La Rioja, 26007 Logroño (La Rioja), España
4 Grupo de investigación Antioxidantes, Departamento de Tecnología de Alimentos, Centro de Investigación Agrotecnio, Universidad de Lleida, Av/Alcalde Rovira Roure, 191, 25198 Lleida, España
5 Laboratorio Cajal de Circuitos Corticales (CTB), Universidad Politécnica de Madrid, Madrid, España
6 Departamento de Química y Bioquímica, Facultad de Farmacia, Universidad San Pablo-CEU
7 Universidad CEU, Urbanización Montepríncipe, 28660, Boadilla del Monte, Madrid, España
8 Instituto Cajal, CSIC, Av. Doctor Arce 37, 28002, Madrid, España