Los microorganismos en los suelos se consideran una fuente prometedora para aumentar la resiliencia de los cultivos en un escenario de calentamiento global. Por ello, con el objetivo de explorar las comunidades bacterianas y fúngicas de suelos áridos de viñedos mendocinos, investigadores del INTA, Conicet, la UNCuyo y el laboratorio de servicios especializados en microbiología enológica Biovin, realizaron un estudio de caracterización en los suelos de dos regiones de la provincia de Mendoza con historiales de cultivo y clima muy diferentes: Santa Rosa y Gualtallary. Así, se pudieron conocer los recursos microbianos disponibles para abordar varias preocupaciones importantes en la viticultura, como la escasa disponibilidad de nitrógeno, la eficiencia en el uso del agua, el estrés abiótico y las deficiencias de nutrientes del suelo.

La revista especializada en vitivinicultura Oeno One, de la Sociedad Internacional de Viticultura y Enología (IVES por sus siglas en inglés) publicó recientemente (el 20/2/23) un estudio titulado «Microbioma en suelos de Mendoza: recursos microbianos para el desarrollo del manejo agroecológico en vitivinicultura».
El mismo fue realizado por investigadores argentinos del Instituto Nacional de Tecnología Agropecuaria (INTA), del Consejo Nacional de Investigaciones Científicas y Técnicas (Conicet), de la Universidad Nacional de Cuyo (UNCuyo) y del laboratorio de servicios especializados en microbiología enológica Biovin: Marcos Paolinelli, Laura Elizabeth Martínez, Sandra García-Lampasona, Camilo Díaz-Quirós, Marcelo Belmonte, Gastón Ahumada, Miguel Ángel Pirrone, Marisa Diana Farber, Georgina Escoriaza, Valeria Longone, Magalí González, Cecilia Lerena, Mariana Combina y Laura Analía Mercado. Y fue realizado gracias a un contrato STE entre INTA y Grupo Peñaflor SA y financiamiento de la Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación de Argentina. A continuación replicamos parte del informe publicado.
La riqueza de la rizosfera
Los microorganismos de la rizosfera se consideran una extensión de las plantas y representan actores críticos involucrados en la promoción de la ingesta de nutrientes de las plantas del entorno circundante. En consecuencia, se está prestando mucha atención a los microorganismos del suelo, ya que se consideran una fuente prometedora para mejorar la resiliencia de los cultivos en un escenario de cambio climático global.
Para explorar las comunidades bacterianas y fúngicas de suelos áridos en viñedos y sus alrededores de dos regiones con historiales de cultivo y clima muy diferentes, se realizó un análisis de secuenciación de amplicones (conjunto de moléculas de ADN idénticas, resultado de una reacción en cadena de la polimerasa).
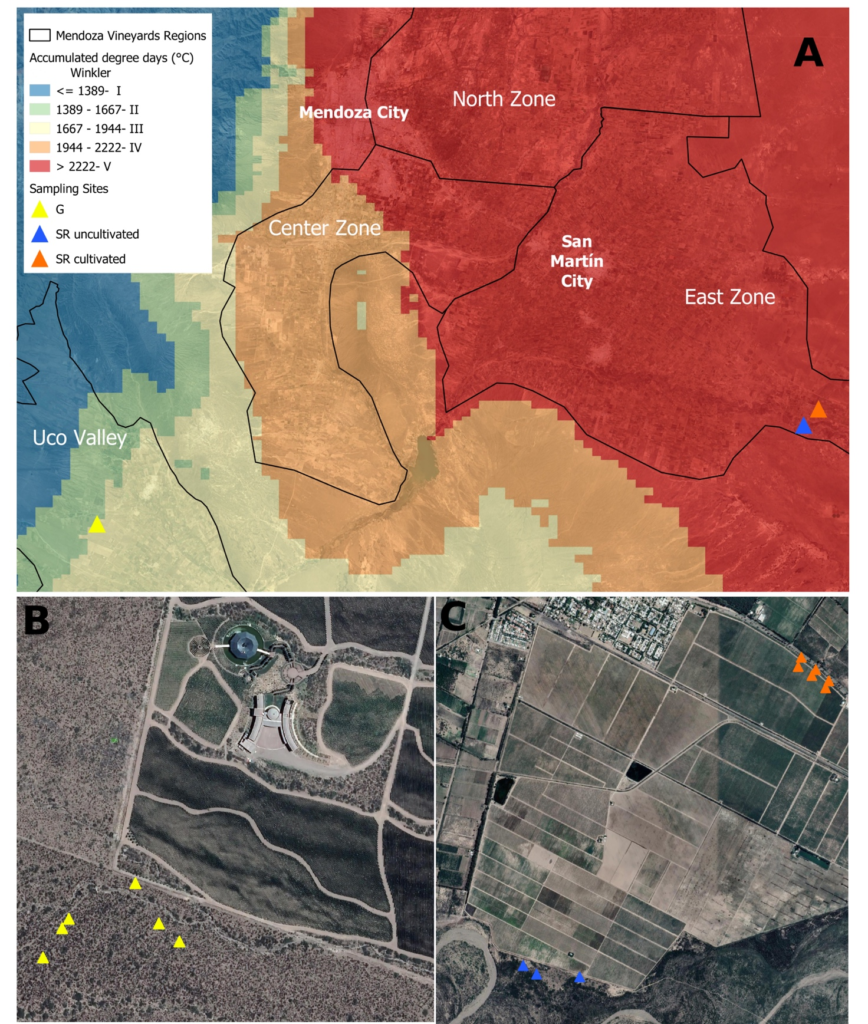
Específicamente, las regiones estudiadas fueron Santa Rosa (SR), que se encuentra en una región conocida comúnmente como la Primera Zona, caracterizada por su baja altitud (607 msnm, Winkler V) y Gualtallary (G), en la Zona del Valle de Uco, una región de gran altitud (1.245 msnm). , Winkler III); ambos en la productiva región vitivinícola de Mendoza. SR se caracteriza por su larga historia de cultivo, mientras que G es una región de cultivo reciente.
Se recogieron muestras de suelo y se usaron para la caracterización del perfil de la comunidad bacteriana y fúngica. Ascomycota fue el filo predominante (38-97 %) en la composición del micobioma, mientras que Proteobacteria fue el filo bacteriano más abundante (26-34 %) en ambas regiones.
Diferencia en la relación carbono-nitrógeno
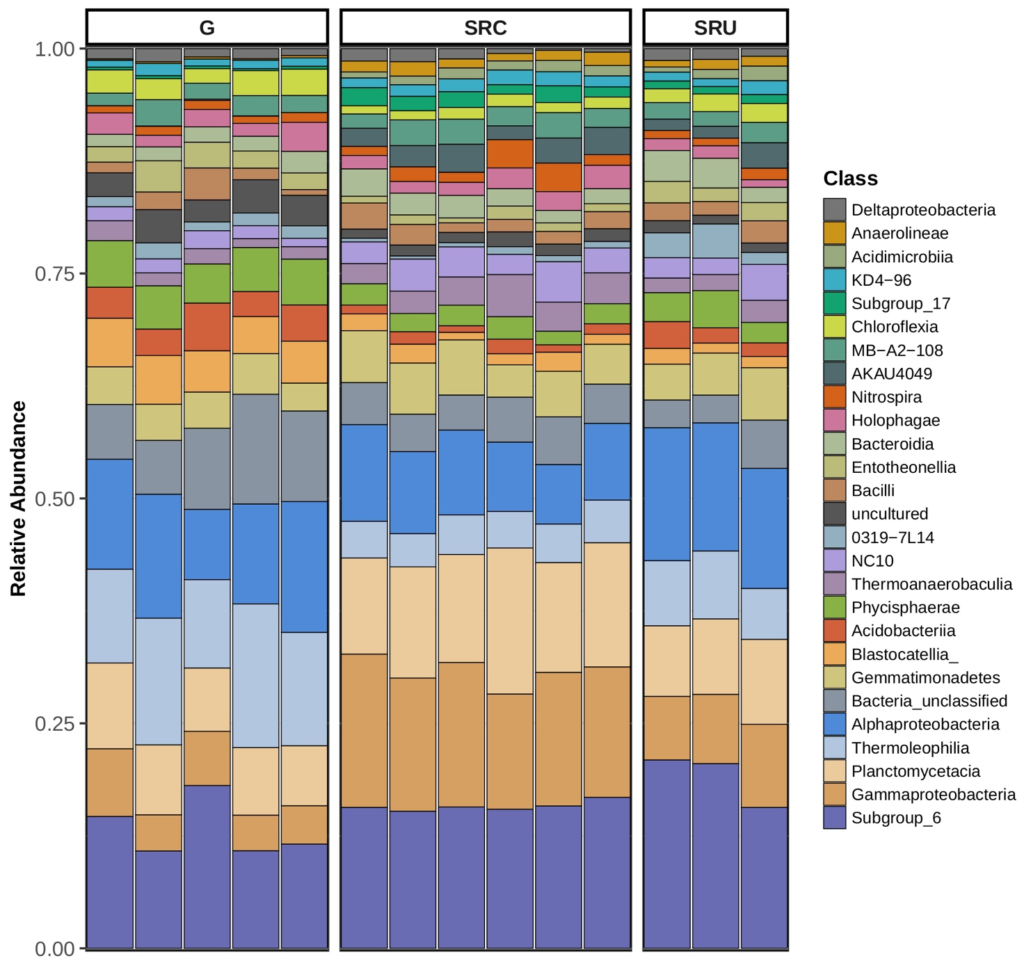
Además, el factor principal que explica las diferencias de microbioma entre regiones fue la relación carbono-nitrógeno. Anaerolineae y Gammaproteobacteria fueron una clase bacteriana distintiva en suelos cultivados con SR. Los azospirillales fueron muy abundantes en los suelos baldíos del SR, mientras que los Rhizobialesfueron diferencialmente abundantes en suelos no cultivados.
En cuanto al análisis funcional, los suelos de SR mostraron una mayor actividad desnitrificadora de los nitrificantes así como un metabolismo relacionado con la glucosa, mientras que en los suelos G, las actividades de fotosíntesis bacteriana fueron un rasgo diferencial.
Además, la abundancia de actinobacterias fue menor en los suelos cultivados de SR, lo que indica una mayor susceptibilidad de este filo a las prácticas de cultivo de la vid. Estos resultados permiten desarrollar modelos hipotéticos de los recursos microbianos locales y su contribución a la nutrición de la vid, lo cual es de gran importancia para elaborar recomendaciones de manejo de la vid para preservar la salud del suelo en las zonas vitivinícolas de Mendoza.
Estudios previos en microbiomas de suelos de viñedos indican que los microorganismos están determinados principalmente por una variable biogeográfica en el caso de las bacterias, mientras que las comunidades de hongos muestran una reestructuración de acuerdo a las prácticas de manejo agrícola (Chou et al. , 2018 ; Coller et al. , 2019).
El papel del microbioma del suelo en la prevención de las enfermedades de Vitis vinifera es otro aspecto importante que se está estudiando actualmente. En este sentido, se ha demostrado que los patógenos causantes de enfermedades del tronco de la vid son más abundantes en suelos de viñedos sintomáticos, lo que sugiere que el inóculo del patógeno permanece en el suelo y podría reinfectar la planta (Nerva et al. , 2019). Otros estudios sugieren que la disbiosis que favorece el desarrollo de enfermedades podría explicarse por la disminución de bacterias en el suelo (Sacca et al. , 2019 ; Darriaut et al. , 2021 ; Bettenfeld et al. , 2022).
En el presente estudio, el objetivo fue caracterizar comunidades bacterianas y fúngicas en suelos cultivados y baldíos de vid de la región de Mendoza que difieren en su origen geológico y manejo de labranza del suelo. Estas regiones contrastantes fueron seleccionadas para determinar la relación entre el medio ambiente, el clima y el manejo del viñedo con la composición de la microbiota del suelo.
Recolección de muestras
Se recolectaron -durante el invierno (agosto de 2018)- cinco muestras de suelo del matorral nativo que rodea un viñedo en Gualtallary (G1-G5, Figura 1B, -3340777 a 3340868; -69.22336 a -60.22537), tres muestras de suelo del matorral nativo en Santa Rosa (SRU1-SRU3, Figura 1C , -3327912 a -3327985; -6815158 a -6815624) y 6 muestras de suelos cultivados con Vitis vinifera cv. Malbec (SRC1-SRC6, Figura 1C).
Se usó una barrena para hacer seis submuestras de la capa superior del suelo en el medio de la hilera a una distancia mínima de 50 cm de las plantas circundantes. Las submuestras se mezclaron y tamizaron para eliminar cualquier residuo vegetal y se recogieron 2 kg en bolsas de plástico para el análisis fisicoquímico. Las muestras para la secuenciación de amplicones se recolectaron en tubos cónicos de 50 mL, se congelaron inmediatamente con nitrógeno líquido y finalmente se almacenaron a -80 °C.
Extracción y secuenciación de ADN: La extracción de ADN se realizó utilizando un kit de ADN de suelo Macherey Nagel Nucleospin siguiendo las instrucciones del fabricante. La secuenciación se llevó a cabo en formato Illumina MiSeq TM paired-end 2 × 300bp. Las lecturas sin procesar resultantes se depositaron en BioProject en NIH-NCBI (PRJNA833442).
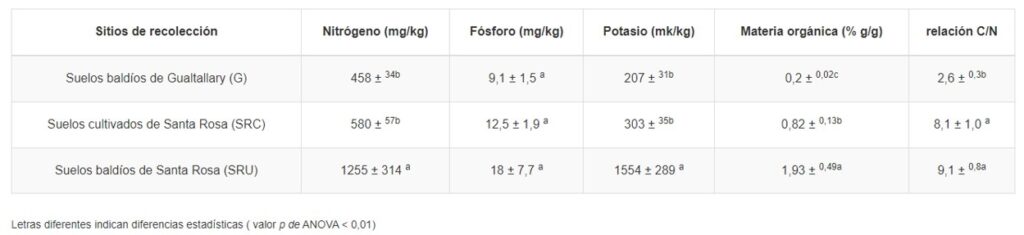
Análisis de fertilidad del suelo: La materia orgánica (MO) en las muestras de suelo se determinó de acuerdo con el método de Walkley-Black. El nitrógeno total (N) se midió utilizando el método Kjeldahl. El fósforo disponible (P) se cuantificó mediante el método de Bray. El potasio intercambiable (K) se determinó con base en el método del acetato de amonio. Todos los métodos se realizaron como se describió previamente por Página et al. (mil novecientos ochenta y dos).
También se hicieron determinaciones de la diferencia normalizada en el índice de vegetación (NDVI), en los matorrales que rodean los viñedos.
Resultados
Fertilidad del suelo: Con el objetivo de relacionar la abundancia de microorganismos con la disponibilidad de nutrientes para las plantas, se determinó en muestras de suelo el contenido de macronutrientes, MO y relación C:N. Todas las variables, excepto el fósforo, fueron más abundantes en los suelos SRU que en los suelos SRC y G (Cuadro 1). La MO fue diferente en todos los sitios de colecta (ANOVA p -value < 0.01), alcanzando los valores más bajos en suelos de Gualtallary e intermedios en suelos cultivados de Santa Rosa, mientras que los contenidos más ricos se observaron en suelos baldíos de Santa Rosa.
Composición del microbioma bacteriano: los filos más representativos detectados fueron Proteobacteria (26–34 %), Actinobacteria (10–25 %), Acidobacteria (11–20 %), Planctomycetes (8–14 %), Chloroflexi (5–8 %) y Bacteroidetes (3–8 %) (Figura S1).
Composición de la comunidad fúngica: Ascomycota (38–97 %) fue el filo fúngico más representado en las muestras de suelo analizadas, seguido de Basidiomycota (1–59 %) y específicamente en SRC, el tercer filo más abundante fue Zygomycota inc. sed. (G: 0–1 %, SRC: 5–12 %, SRU: 0,8–1 %). Por otro lado, en suelos G, el tercer filo más abundante fue Chytridiomycota (G: 0.4–4 %, SRC: 0.02–1 %, SRU: 0.1–2 %). Glomeromycota fue el cuarto filo más representado (G: 0.4–4 %, SRC: 0.02–1 %, SRU: 0.1–2 %) en suelos no cultivados de Gualtallary (Figura S2).
Al comparar la abundancia de géneros de hongos entre los sitios de recolección, Mortierella, Alternaria, Fusarium, Coprinellus, Metarhizium, Retroconis, Arthrographis y Acremonium fueron más abundantes en los suelos SR (umbral lda > 2, umbral Kruskal < 0,05 y umbral Wilcox < 0,05; Figura S3B).
Por el contrario, Umbilicaria (hongo formador de líquenes), Lophiostoma, Rhizophlyctis, Phaeococcomyces, Coniochaeta, Aureobasidium y Deniquelatalos géneros de hongos fueron más abundantes en los suelos G (umbral lda > 2, umbral Kruskal < 0,05 y umbral Wilcox < 0,05; Figura S3B).

Sorpresa: suelos no cultivados más ricos que los cultivados
Los sitios seleccionados mostraron grandes diferencias en cuanto al contenido de nutrientes y materia orgánica (Cuadro 1), donde los suelos no cultivados de Santa Rosa fueron mucho más ricos que los suelos cultivados. Este fue un resultado inesperado considerando el régimen de riego y fertilización de las áreas cultivadas con vid.
Observaciones similares han sido reportadas previamente en un estudio similar realizado en suelos de San Juan (Vega-Ávila et al. , 2018) y se atribuyeron a la presencia de “plantas nodrizas” cuya sombra promueve el crecimiento de plantas anuales durante los períodos húmedos y luego mueren durante las estaciones secas. En consecuencia, el material vegetal muerto proporciona recursos para el crecimiento microbiano y, por tanto, favorece la disponibilidad de nutrientes.
Aunque la copa de la vid también genera sombra, no parece comportarse del mismo modo que los arbustos para el vivero de otras plantas. Esto podría atribuirse posiblemente a la falta de equilibrio entre las plantas anuales y los degradadores microbianos debido al manejo de la vid, como la adición de insumos químicos o la compactación del suelo.
Por otro lado, los suelos cultivados de Gualtallary mostraron mayor contenido de nutrientes que los suelos no cultivados (datos no mostrados). Los sitios no cultivados en G tenían un NDVI más bajo que SR (Tabla S4).
Los recursos microbianos del suelo podrían ser una alternativa prometedora para abordar varias preocupaciones importantes en la viticultura, como la escasa disponibilidad de nitrógeno, la eficiencia en el uso del agua, el estrés abiótico, las deficiencias de nutrientes del suelo debido a la erosión del fosfato y la presencia de nematodos.
En la presente discusión, nos enfocamos en microorganismos con un papel ecológico bien documentado, detectados en abundancia suficiente en nuestros datos y que podrían tener el potencial de usarse para promover la salud del suelo o al menos mitigar la erosión causada por el cultivo de la vid.
Recursos microbianos disponibles en los suelos analizados en este estudio
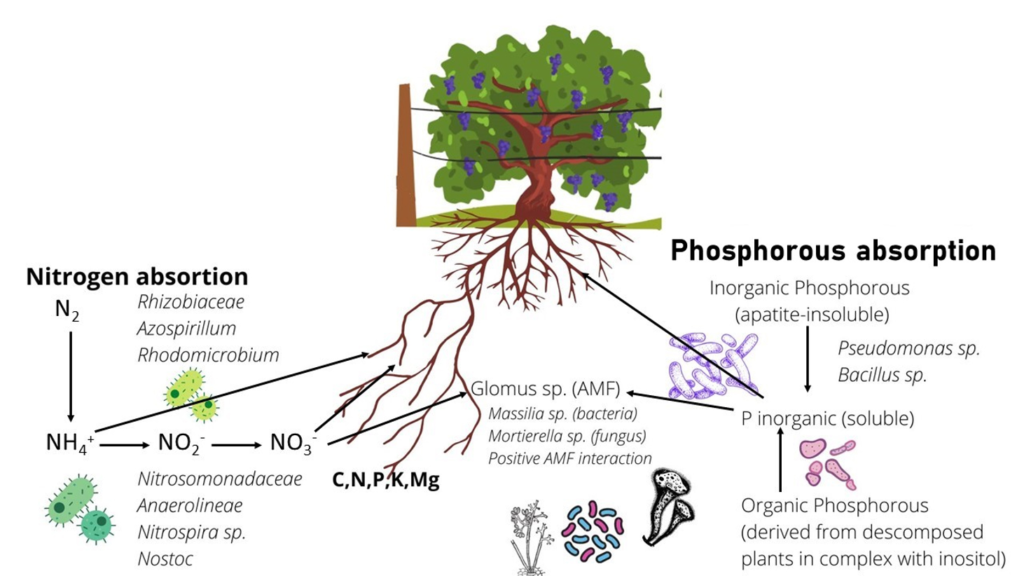
En la Figura 8 se muestra un modelo esquemático para resumir los recursos microbianos disponibles en los suelos analizados en este estudio: Oxalobacteraceae Massiliasp., miembro de la familia Burkholderiaceae, puede solubilizar P y tener una interacción positiva con hongos micorrízicos arbusculares (HMA) ( Scheublin et al. , 2010 ). Esta bacteria se encontró con mayor abundancia en suelos no cultivados (G y SRU), lo que sugiere que estos suelos nunca expuestos a labranza podrían tener una mayor capacidad de solubilización de P.
El hongo Mortierella sp., también conocido por su interacción positiva con los HMA y la capacidad de solubilización del fósforo ( Zhang et al. , 2011 ; Ozimek y Hanaka, 2020), estuvo más representado en el microbioma de los suelos SRC. Esto indica que se representan diferentes microorganismos con la capacidad de interactuar con los HMA y solubilizar P, posiblemente influenciados por las especies de plantas presentes en la superficie del suelo. Esto podría explicarse por la interacción del sistema de raíces de diferentes plantas (vid en lugar de arbustos nativos) con diferentes HMA y, por lo tanto, también con diferentes bacterias u hongos asociados con dichos HMA. Además, Proteobacteria, Gammaproteobacteria y Anaerolineae mostraron una mayor representación en los suelos SR.
Por otro lado, en suelos SRC, la aplicación de N podría perturbar el ciclo biogeoquímico de C y N, promoviendo el crecimiento de microorganismos más generalistas como Gemmatimonadetes , y desnitrificantes como Anaerolineae (Jiménez-Bueno et al. , 2016). Anaerolineae también se ha asociado con un proceso anaeróbico inducido por la compactación del suelo (Hartman et al. , 2014). La alta representación de Anaerolineae en SRU fue inesperada y difícil de explicar. No obstante, una posible interpretación podría ser la menor altitud de los sitios de recolección con respecto al viñedo, lo que podría conducir a un drenaje de nitrógeno de los sitios de cultivo a los sitios silvestres circundantes, beneficiándose del aporte externo de N y, por lo tanto, alterando la composición microbiana.
Las diferencias en la composición bacteriana fueron fuertemente respaldadas por la variable geográfica más que por el manejo del cultivo. En cuanto al microbioma fúngico, la diversidad alfa y beta indican que, a diferencia de nuestras observaciones sobre la composición bacteriana, los hongos están más influenciados por variaciones locales, como el manejo del cultivo de vid en Santa Rosa.
La mayor sensibilidad de los hongos a la labranza del suelo, en comparación con las bacterias, podría deberse al crecimiento filamentoso de los hongos. Es más probable que este tipo de crecimiento sea interrumpido por efectos mecánicos que el tipo unicelular de crecimiento bacteriano.
Con respecto a la composición química del suelo, nuestros resultados sugieren que la relación carbono-nitrógeno (C:N) fue el principal factor que impulsó las diferencias observadas en la composición bacteriana y fúngica entre las dos regiones evaluadas.
Conclusiones
En el presente estudio, evaluamos la composición microbiana de diferentes sitios clasificados por Winkler, así como de suelos cultivados y no cultivados con vid. Con base en nuestros resultados, se propuso un modelo de los roles de los microorganismos en contextos ecológicos y funcionales.
La identificación de actividad microbiana desnitrificadora nitrificante en suelos cultivados con vid SR sugiere que el aporte de amonio promueve el crecimiento de dichos taxones, y esta actividad podría favorecer la liberación de óxido nitroso, impactando el medio ambiente y reduciendo la eficiencia de la fertilización.
La identificación de la actividad de síntesis de clorofila en suelos G destaca la importancia de los fotótrofos (posiblemente formando o promoviendo la formación de BSC) en aquellos suelos no perturbados y muy expuestos a la radiación UV.
Las asociaciones del manejo agronómico en el viñedo con los cambios en la estructura del microbioma y los perfiles funcionales contribuirían a seleccionar prácticas de cultivo que preserven y promuevan la diversidad microbiana y el equilibrio ecológico. En este estudio también se describieron microorganismos con un supuesto impacto beneficioso sobre el interés ecológico y agrícola.
Para ver e informe completo clikeá AQUÍ