Este estudio científico-enológico de investigadores sudafricanos (ver fuentes al pie) destaca el rol del AN en el equilibrio redox y los procesos metabólicos en Saccharomyces cerevisiae, y en particular como ayudante para la regeneración del NAD⁺ y una cinética de fermentación eficiente. Niveles deficientes de AN conducen a un desbalance redox severo, ya que el agotamiento del NAD⁺ resultante dificulta las funciones metabólicas centrales, ralentizando la fermentación y reduciendo la biomasa.

El ácido nicotínico (AN), una forma de la vitamina B3, es un precursor de los cofactores redox esenciales NAD⁺ y NADP, los cuales son vitales para varios procesos metabólicos. En Saccharomyces cerevisiae, la producción de estos cofactores bajo condiciones anaeróbicas ocurre exclusivamente mediante la recuperación de varias formas de la vitamina B3, enfatizando la importancia de la disponibilidad de AN en el mosto de uva. En este estudio se investiga el impacto de la deficiencia de AN en el desempeño de la fermentación en S. cerevisiae y el subsecuente impacto en la impronta metabólica del vino.
Impacto negativo en la cinética de la fermentación alcohólica
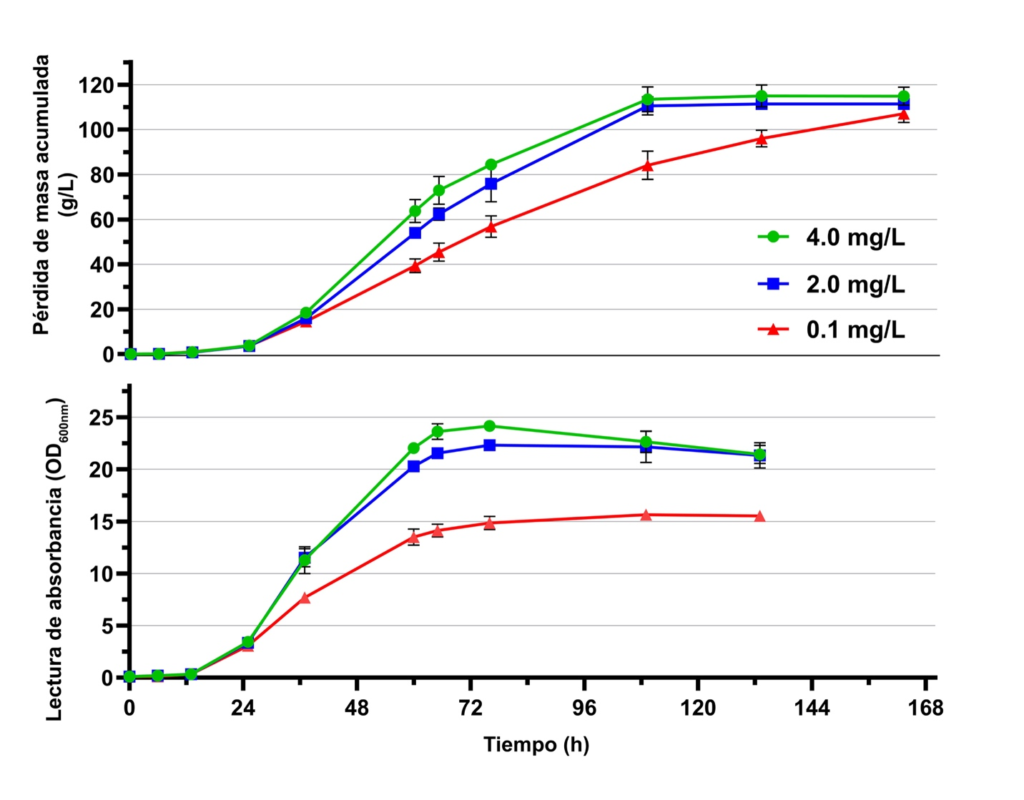
Las cinéticas de fermentación de Saccharomyces cerevisiae EC1118™ (Lallemand Inc, QC, Canadá) (Figura 1) fueron comparadas en un medio de mosto sintético de uva que contenía 230 g/L de azúcares (mitad glucosa, mitad fructosa), con tres concentraciones diferentes de ácido nicotínico (AN) a 25 ºC. Este rango abarcó los niveles de deficiencia (0,1 mg/L), promedio (2,0 mg/L) y exceso (4,0 mg/L) de vitamina típicamente medida en el mosto de uva, aunque las concentraciones reales pueden variar considerablemente.
Mientras que la cinética de la fermentación monitoreada como la pérdida acumulada de masa pareció ser similar durante las primeras 24 horas (fase de latencia e inicio de la fase exponencial), niveles deficientes de AN resultaron en una fermentación más lenta y una reducción del 37,5 % en la producción de biomasa de la levadura. Resulta interesante que niveles excesivos de AN tuvieron poco impacto sobre la tasa de fermentación y la biomasa en comparación con las concentraciones normales.
A pesar de que la fermentación con S. cerevisiae fue completa en este trabajo, otro estudio reciente mostró que la limitación de AN en especies no-Saccharomyces tales como Kluyveromyces marxianus y Lachancea thermotolerans redujeron aún más las tasas de fermentación y alteraron la producción de metabolitos. Por otro lado, en Starmerella bacillaris, la limitación de AN tuvo un impacto mínimo en las tasas tempranas de fermentación pero resultó en una actividad metabólica reducida durante la fase estacionaria, conduciendo a una fermentación interrumpida prematuramente. Aunque estos resultados fueron obtenidos principalmente en cepas específicas, estos hallazgos sugieren diferencias específicas en respuesta a la limitación de este nutriente, así como las improntas metabólicas únicas que resultan para cada levadura.
Desbalance de los cofactores redox
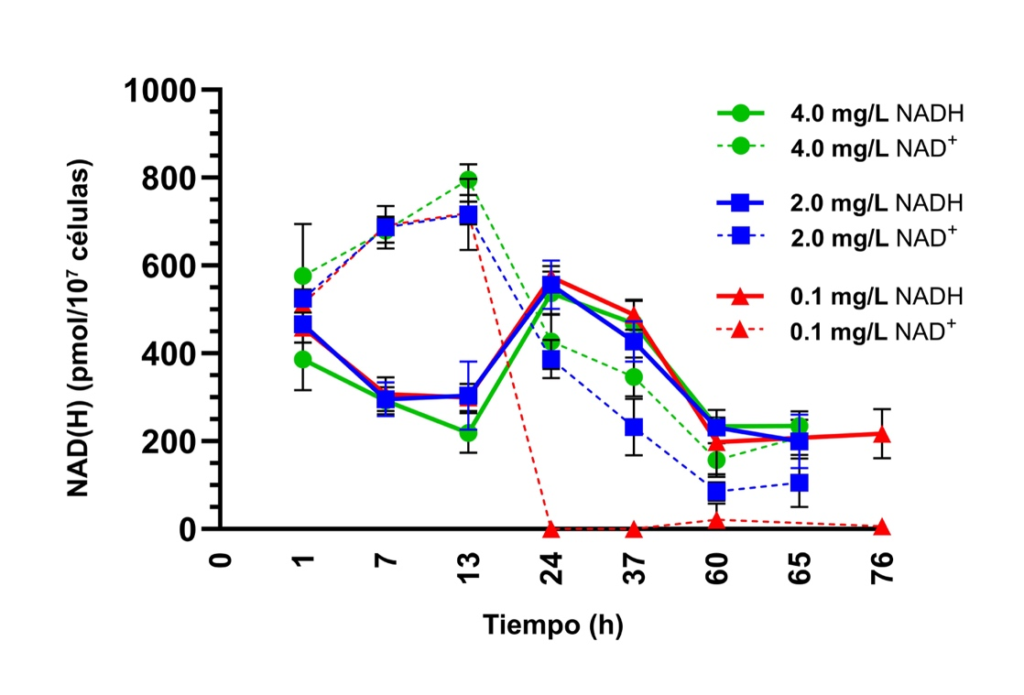
Las concentraciones de los cofactores redox NAD⁺ y NADH fueron cuantificadas a lo largo de la fermentación (Figura 2). Inicialmente, los niveles de NAD⁺ (la forma oxidada) aumentó hasta el final de la fase de latencia (13 h). Cuando las células transitaron a la fase exponencial, los niveles de NAD⁺ cayeron drásticamente en cada tratamiento, reflejando el arranque de la actividad metabólica y un aumento en la tasa de crecimiento celular. Durante esta fase, el NAD⁺ es rápidamente reducido a NADH, que se acumula durante la glucólisis y el ciclo de los ácidos tricarboxílicos. La producción de etanol, dióxido de carbono y otros metabolitos refleja la estrategia de la levadura para mantener el balance entre los cofactores oxidados y reducidos.
No obstante, a pesar de los intentos de la levadura durante este pico de actividad metabólica, la reducción del NAD⁺ no es completamente igualada por una reoxidación equivalente de NADH. Este desbalance resulta en un declive de los niveles tanto de NAD⁺ como de NADH después de 24 h. En el tratamiento de deficiencia con 0,1 mg/L de AN, se hizo evidente un desbalance redox severo, y los niveles de NAD⁺ se volvieron casi indetectables después de este punto. Esta escasez de NAD⁺ debida a los precursores limitados explica la cinética de fermentación ralentizada y la producción disminuida de biomasa. Este desbalance redox perjudica los procesos metabólicos clave, conduciendo a fermentaciones ralentizadas en S. cerevisiae y fermentaciones interrumpidas prematuramente en numerosas levaduras no-Saccharomyces, debido a la regeneración insuficiente del NAD⁺ que conduce al declive de la levadura.
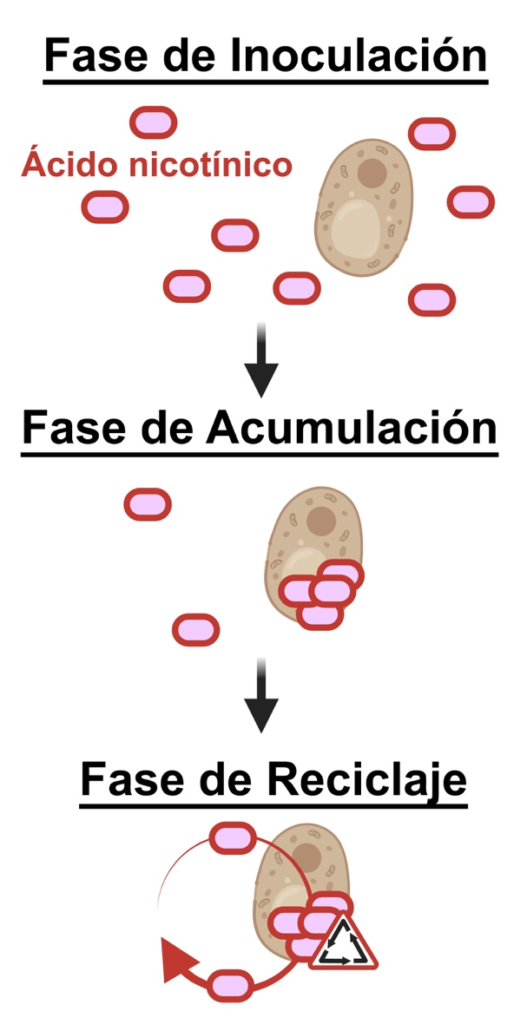
Dinámica de la importación y metabolismo del ácido nicotínico
Se determinó la importación y el destino metabólico del AN, y se esbozó bajo la forma de un esquema simplificado en la Figura 3. La primera fase ocurre inmediatamente después de la inoculación, cuando la levadura se adapta al ambiente del mosto de uva incrementando gradualmente su metabolismo, movilizando sus reservas de vitamina B3 e importando el AN como substrato para la síntesis de NAD⁺. Esta es seguida por una fase de acumulación, en la que las células consumen rápidamente todo el AN disponible en el medio. Esto se alcanza antes del 50 % del crecimiento máximo de la levadura.
A partir de entonces, la fase de reciclaje consiste en la conversión del NAD⁺ en varias formas de la vitamina B3 en la célula. Incluso se observó un exporte limitado, aunque cuantificable, de vitamina B3 de vuelta al medio. Tanto la importación como la exportación de AN son proporcionales al grado de suplementación inicial, con las mayores concentraciones de AN que conllevan a una mayor exportación en las etapas tardías.
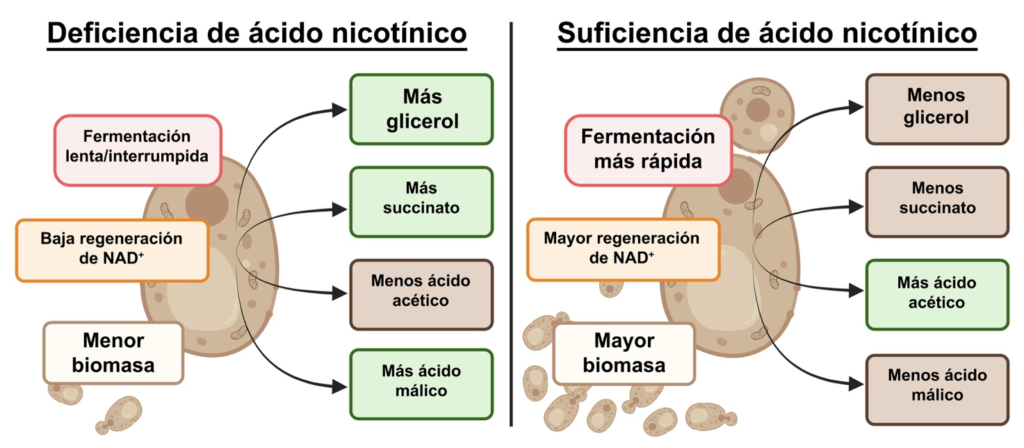
La deficiencia impacta la producción de los metabolitos mayores
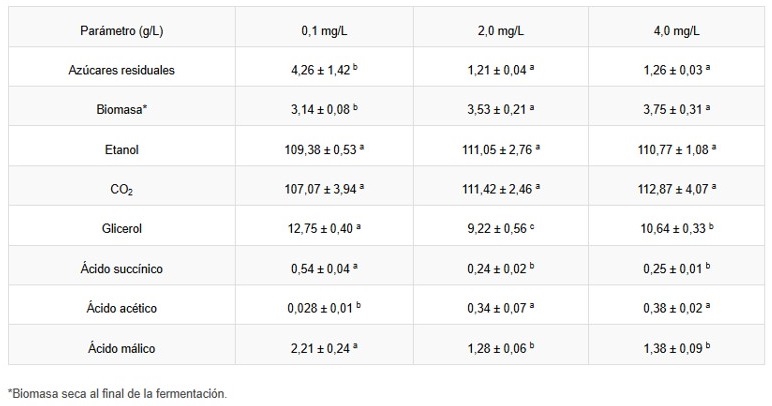
Se cuantificaron las concentraciones de metabolitos primarios producidos entre los tres tratamientos para determinar el impacto de la disponibilidad de AN (Tabla 1) en mosto sintético de uva. El tratamiento con AN a 0,1 mg/L tuvo claramente un impacto profundo en el metabolismo de la levadura, pero se observaron cantidades similares de metabolitos entre los tratamientos con AN a 2,0 mg/L y 4,0 mg/L. Esto indica la existencia de un umbral, punto a partir del cual un mayor suplemento de AN no mejoraría la producción de metabolitos ni la dinámica de fermentación.
No obstante, niveles deficientes de AN resultaron en saltos significativos en la producción de metabolitos, como se resume en la Figura 4. Específicamente, se observaron incrementos en la producción de glicerol, ácido málico y acetoína como mecanismos compensatorios para la regeneración del NAD⁺, así como un incremento de ácido succínico pero una disminución de ácido acético. La cantidad de etanol no se vio afectada por la concentración de AN, confirmando el rol altamente conservado de la producción de etanol en las levaduras. Esto resalta la necesidad de niveles adecuados de vitamina B3 no solo para mantener el balance redox y una fermentación eficiente, sino también para perfiles de metabolitos estables.
¿Cuándo ocurren las deficiencias en el mosto de uva?
La deficiencia de vitamina B3 en el mosto está lejos de ser tan común como la de vitamina B1 (tiamina), que puede ocurrir con frecuencia. No obstante, las infecciones fúngicas de la uva tales como las de Botrytis cinerea agotan los nutrientes, reduciendo activamente las concentraciones de AN en el mosto después del procesado.
Estudios sobre las etapas tempranas de la fermentación también indican que la tiamina y otras vitaminas B son rápidamente asimiladas por las levaduras, limitando así su disponibilidad a medida que la fermentación progresa. Es también probable que una maceración prefermentativa prolongada y/o una inoculación secuencial con levaduras no-Saccharomyces reduzcan aún más los niveles de AN en el medio, agudizando los riesgos asociados con su deficiencia.
Mientras estas causas potenciales de la deficiencia aún necesitan ser confirmadas experimentalmente, la suplementación con nutrientes derivados de levaduras que contengan vitamina B3 es una estrategia potencialmente viable para prevenir tales deficiencias en los escenarios de riesgo antes mencionados. La adición controlada de oxígeno también se muestra prometedora, ya que el oxígeno permite la biosíntesis de novo de vitamina B3 por las levaduras, reduciendo su dependencia de fuentes externas de AN. No obstante, optimizar el momento y la concentración de la adición de oxígeno, y en particular durante las etapas tempranas o medias de la fermentación, es clave para asegurar la producción adecuada de niacina sin comprometer la fermentación.
Conclusión
Este estudio destaca el rol del AN en el equilibrio redox y los procesos metabólicos en S. cerevisiae, y en particular como ayudante para la regeneración del NAD⁺ y una cinética de fermentación eficiente. Niveles deficientes de AN conducen a un desbalance redox severo, ya que el agotamiento del NAD⁺ resultante dificulta las funciones metabólicas centrales, ralentizando la fermentación y reduciendo la biomasa. En contraste, niveles excesivos de AN no mejoran la cinética de fermentación ni la producción de metabolitos más allá de lo observado en condiciones promedio, sugiriendo un umbral óptimo para la suplementación con AN.
Además, se han observado respuestas especie-específicas a la deficiencia de AN, con levaduras no-Saccharomyces que muestran perfiles de fermentaciones alteradas. Futuros estudios debiesen enfocarse en afinar las estrategias de suplementación con nutrientes y oxigenación optimizada para la biosíntesis de NAD⁺, con el fin de asegurar fermentaciones fluidas y/o inducir cambios metabólicos favorables.
Fuentes: IVES Technical Review 28/3. Extraído del artículo de investigación:“Nicotinic acid availability impacts redox cofactor metabolism in Saccharomyces cerevisiae during alcoholic fermentation” (FEMS Yeast Research). Autores: James D. Duncan y Benoit Divo, de South African Grape and Wine Research Institute, Stellenbosch University.