En los últimos años, el cambio climático y el aumento de las temperaturas han tenido un efecto significativo en la industria de la uva y el vino. Las fechas de cosecha se han adelantado considerablemente en las últimas décadas, lo que está afectando negativamente a la calidad del vino. La gestión de la acidez del vino es un desafío muy importante, especialmente frente a estas nuevas condiciones climatológicas y a su impacto en la química de las plantas. En este artículo científico, una revisión de los actuales métodos de acidificación química, física y microbiológica del mosto y del vino.

Por Claire Payan, Anne-Laure Gancel, Michael Jourdes, Monika Christmann y Pierre-Louis Teissedre
(del artículo original en inglés «Wine acidification methods: a review», publicado el 11 de agosto de 2023 por la revista científica OENO One, de la Sociedad Internacional de Viticultura y Enología).
Debido al aumento de las temperaturas globales por efecto del cambio climático, las uvas maduran mucho más rápido, con niveles más altos de azúcar y concentraciones más bajas de ácidos orgánicos. La tendencia a valores de pH más altos conduce a un riesgo creciente de contaminación microbiana y a vinos generalmente inestables.
El pH tiene un efecto directo sobre la eficacia del anhídrido sulfuroso (SO2), que se encuentra en el vino principalmente en dos formas: SO2 libre y SO2 combinado. El SO2 libre existe en tres formas: SO2 molecular, bisulfito (HSO3-) y sulfito (SO32-); la proporción de estas tres formas depende del pH del vino. El bisulfito es la principal forma de SO2 libre (94 a 99 %) que se encuentra en el vino. El bisulfito se une al acetaldehído, que es un subproducto de la oxidación del etanol, un compuesto de particular interés en los vinos de Jerez, pero considerado un defecto en los vinos de mesa. Los sulfitos, por otro lado, están presentes en cantidades muy pequeñas (0,01 a 0,12 %) y ayudan a prevenir la oxidación directa al eliminar el oxígeno libre y las formas reactivas de oxígeno. Los sulfitos también desactivan la enzima polifenoloxidasa, responsable del pardeamiento enzimático.
El SO2 molecular representa del 0,5 al 6 % del SO2 libre total y tiene efecto antiséptico. Los niveles típicos de SO2 molecular necesarios para lograr la estabilidad microbiana están entre 0,6 y 0,8 mg/L (Ribéreau-Gayon et al., 2012). Un pH más alto conduce a una menor actividad antibacteriana del SO2, lo que significa que se necesitan cantidades más altas para proteger los vinos del deterioro temprano y de las alteraciones organolépticas (Lafon-Lafourcade y Peynaud, 1970).
Hoy en día, para alcanzar los mismos niveles de estabilidad microbiana en el vino (pH 4, 15 % de alcohol por volumen almacenado a 15 °C), los niveles de SO2 libre deberían estar entre 95 y 126 mg/L. Estos valores implican que el SO2 total en el vino puede superar los límites legales establecidos por la OIV (Resolución OIV OENO 09/1998).
Estas características (es decir, pH y SO2 elevados) hacen que sea muy difícil controlar el desarrollo de bacterias. El pH alto (> 3,5) y el SO2 molecular bajo favorecen la formación de compuestos volátiles indeseables, que producen los desagradables olores a ratón o paño húmedo, por parte de las bacterias lácticas (Costello et al., 1993; Grbin et al., 1996).
Un nivel de pH óptimo no sólo es necesario para la estabilidad del vino y el equilibrio microbiológico, sino que también está directamente relacionado con el color y las propiedades sensoriales.
Se ha demostrado que el cambio climático afecta a los antocianos, lo que repercute en el color del vino. Las temperaturas más altas en los viñedos (30 °C y más) conducen a niveles más bajos de antocianos (Buttrose et al., 1971; Spayd et al., 2002; Tarara et al., 2008).
Se sabe que el pH del vino juega un papel importante en el color del vino, porque afecta al equilibrio entre las diferentes formas de antocianos (Brouillard y Delaporte, 1977). También puede condicionar determinadas reacciones de polimerización o condensación de los pigmentos del vino tinto (Gil et al., 2012).
Además, el pH del vino tiene un gran impacto en su percepción sensorial. La acidez total y el pH suelen asociarse a la frescura del vino. La acidez del vino y, más importante aún, el pH del vino, desempeñan un papel importante en la conservación del aroma y el sabor. El pH del vino también puede desempeñar un papel importante en la sensación de acidez y astringencia (Sowalsky y Noble, 1998).
Por lo tanto, la gestión de la acidez del vino es un desafío muy importante, especialmente frente al cambio climático. La práctica más frecuentemente aplicada es la acidificación del mosto y del vino, que consiste en aumentar la acidez total y así disminuir el pH (OIV, 2017). Todas las prácticas de acidificación se realizan de manera que la acidez inicial no aumente en más de 54 meq/L, equivalente a 4 g/L de ácido tartárico (OIV, 2017). En Europa, la acidez máxima permitida para el mosto es de 1,5 g/L y para el vino de 2,5 g/L en equivalentes de ácido tartárico (Reglamento UE 1308, 2013).
Esta revisión se centra en la acidificación química, física y microbiológica del mosto y del vino.
Acidificación química
La acidificación química es un proceso utilizado para ajustar los niveles de acidez en el vino y es el método más popular para reducir el pH en la elaboración del vino. El ácido más utilizado en este proceso es el ácido tartárico, que se encuentra naturalmente en las uvas y desempeña un papel importante en el sabor y la estructura del vino. Sin embargo, además del ácido tartárico, discutiremos otros posibles e importantes agentes acidificantes, como el ácido málico, cítrico, láctico y fumárico, que son utilizados por los enólogos para garantizar la máxima calidad de su producto.
1. Ácido tartárico
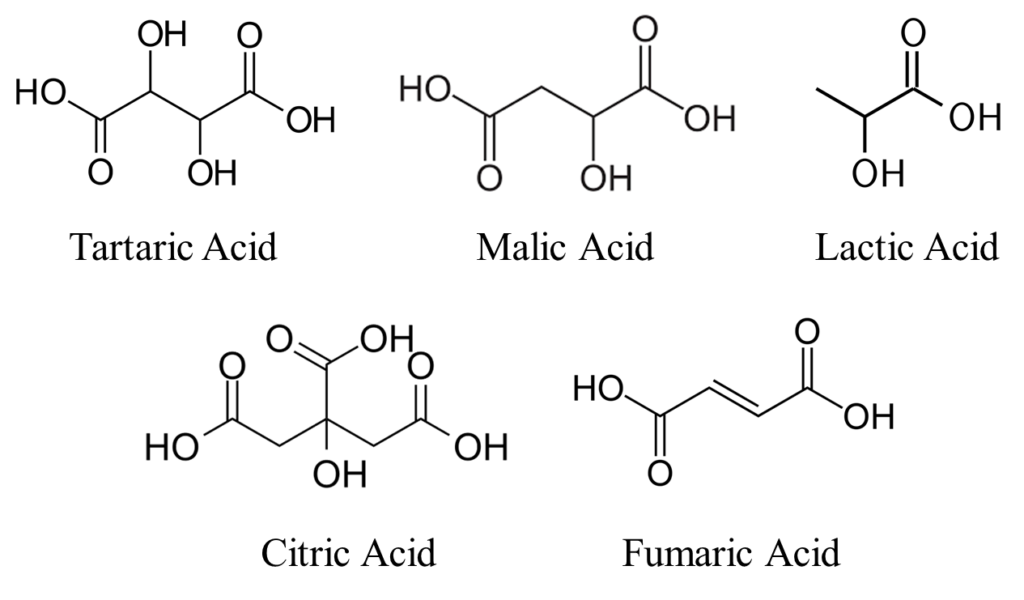
El ácido dihidroxibutanodioico (Figura 1), comúnmente conocido como ácido tartárico (AT), es un ácido diprótico que tiene dos grupos carboxílicos cuyos pKas (a 25 °C) son 2,98 y 4,34 (Figura 2) (Lide et al., 2005). Se utiliza habitualmente como acidificante cuando se necesitan pequeñas correcciones de acidez. AT tiene un sabor amargo y aporta a los alimentos un sabor ácido y picante. A menudo se añade como antioxidante (E334) a productos como bebidas carbonatadas, jaleas de frutas y comprimidos efervescentes. De todos los ácidos orgánicos que ejercen un efecto sobre los microorganismos, el AT es el que tiene menor poder antimicrobiano y el que menos inhibe el crecimiento microbiano (Gurtler y Mai, 2014).
El AT es el ácido más fuerte y está presente de forma natural en las uvas en cantidades entre 5 y 10 g/L. El isómero que se encuentra en las uvas es la forma L-(+)-AT y se sintetiza a partir de glucosa (Saito y Kasai, 1978). El AT fue el primer ácido autorizado por la OIV para la acidificación. El AT se utiliza principalmente en la fase de postfermentación, pero también se puede utilizar en mosto cuando el pH es superior a 3,5.
Cuando se añade al vino o al mosto, el ácido tartárico se disocia formando iones hidronio, que aumentan la acidez total y el bitartrato. A un pH de 3,5, el 23,4 % de AT está presente en su forma no disociada (H2T), el 67,5 % en su forma bitartrato (HT-) y el 9,1 % en su forma totalmente disociada (T2-). El bitartrato (HT-) a menudo reacciona con el potasio para formar bitartrato de potasio, también conocido como hidrogenotartrato de potasio (KHT). El KHT tiene una solubilidad muy baja en agua y puede cristalizar, dando lugar a la precipitación tartárica.
La precipitación de AT es un problema bien conocido y puede ocurrir de manera impredecible. Los cristales de KHT son inofensivos, pero no son bien aceptados por el consumidor. Para ayudar a prevenir este fenómeno, los enólogos eliminan el exceso de sal enfriando el vino a -4 °C durante varios días para inducir la precipitación de KHT antes del embotellado. Una limitación de este método, conocido como estabilización por frío (Maujean, 1994), es que no es posible tener un control total sobre la concentración restante de KHT. Este problema ha llevado al desarrollo de otras técnicas de eliminación de KHT, como las resinas de intercambio iónico (Mourgues, 1993) y la electrodiálisis (Escudier et al., 1993) que se describen a continuación.
La inestabilidad del tartrato de calcio (CaT) en el vino es otro problema relacionado con el AT. De manera similar al bitartrato de potasio (KHT), el calcio puede reaccionar con el ion bitartrato (HT-) para formar tartrato de calcio. Las posibilidades que se produzcan precipitaciones aumentan cuando los niveles de calcio alcanzan los 60 mg/L en el vino tinto y los 80 mg/L en el vino blanco (Ribéreau-Gayon et al., 2012). Si bien es menos común que la inestabilidad del bitartrato de potasio, la inestabilidad del tartrato de calcio es más problemática, ya que no se previene tan fácilmente con métodos de estabilización tradicionales, como el tratamiento de estabilización por frío (Maujean et al., 1984). Un enfoque para prevenir la precipitación de cristales de CaT es el uso de electrodiálisis de la misma manera que se usa para la eliminación de KHT.
Por lo tanto, si bien el ácido tartárico desempeña un papel fundamental en el sabor y la calidad del vino, su interacción con otros compuestos del vino, en particular el calcio y el potasio, requiere una atenta gestión con el fin de mantener la estabilidad y el atractivo estético del producto final. Además, cuando se añade en grandes cantidades, el AT puede inducir un sabor amargo y aumentar la astringencia del vino y ser responsable del sabor tartárico.
2. Ácido málico
El ácido málico (MA) (Figura 1), o ácido 2-hidroxibutanodioico, es un ácido diprótico, cuyos pKas a 25 °C son 3,40 y 5,11 (Figura 3) (Lide et al., 2005). A un pH de 3,5, el 47 % de la concentración total de AM está presente en su forma no disociada (H2M), el 51,7 % en la forma disociada (HM-) y sólo el 1,2 % en la forma totalmente disociada (M2-) (Usseglio- Tomasset, 1985).
El AM es el ácido de la fruta más extendido. Tiene un sabor que recuerda a la manzana y contribuye al sabor amargo de las manzanas verdes. Se utiliza principalmente como acidificante (E296) en productos que contienen manzana, como la sidra, debido a su sabor. AM tiene un impacto directo sobre las propiedades organolépticas de los vinos; aumenta la acidez y la frescura de los vinos al tiempo que reduce el pH (Amerine y Ough, 1970; Carvalho et al., 2001).
Antes del envero, la concentración de AM se puede encontrar en cantidades de hasta 25 g/L. En el momento de la cosecha, la concentración de ácido málico en las bayas disminuye drásticamente hasta 1 – 6,5 g/L (Ribéreau-Gayon et al., 2012; Ruffner et al., 1982). Esta reducción en la concentración de AM se debe al proceso de respiración durante el cual se metaboliza el ácido málico. En climas más cálidos, la pérdida de ácido málico a través de la respiración es más pronunciada. Los niveles de concentración de ácido málico están directamente relacionados con la madurez y la temperatura (Buttrose et al., 1971; Kliewer, 1971).
Durante la elaboración del vino, el ácido L-málico puede transformarse en ácido láctico durante la fermentación maloláctica (FML) por la acción de las bacterias lácticas (BL). La FML ocurre frecuentemente en vinos tintos y rara vez en vinos blancos. La eliminación del ácido málico mediante FML suele inducir un aumento medio del pH de 0,1 a 0,3 (Margalit, 1997). Cuando se añade antes de la fermentación se utiliza una mezcla racémica de ácido málico, de la cual la mayor parte del ácido L-málico será eliminado por la FML y, por su resistencia al ataque microbiano, quedará el ácido D-málico, manteniendo el vino a un pH bajo.
Agregar ácido málico al vino terminado podría ser útil en el caso de los vinos tintos de regiones más cálidas, donde las altas temperaturas conducen a concentraciones más bajas de ácido málico. Este ácido, sin embargo, constituye un sustrato favorable para el crecimiento de BL. Debido a esta característica, no se debe contemplar el uso de AM para acidificación para ajustar el pH o la acidez total; más bien, se puede considerar que esta sustancia permite a las BL llevar a cabo sus propias rutas metabólicas, aumentando la complejidad aromática y gustativa del producto final. Sin embargo, debido a que la adición de AM puede iniciar una segunda FML, esto puede hacer que el vino se vuelva turbio y ligeramente espumoso.
3. Ácido láctico
El ácido láctico (LA) (Figura 1), ácido 2-hidroxipropanoico, es un ácido monoprótico, cuyo pKa a 25 °C es 3,86 (Figura 4) (Lide et al., 2005), lo que significa que es un ácido más débil que el AT y AM. En la industria alimentaria, el AL se utiliza como conservante, agente endurecedor y aromatizante (E270).
Las BL sintetizan AL a partir de ácido málico mediante la MLF. Debido a que el AL es menos ácido que el AM, la FML disminuye la acidez total y, como se mencionó anteriormente, induce un aumento promedio del pH de 0,1 a 0,3 (Margalit, 1997). La FML se puede evitar para mantener una mayor acidez de los vinos de zonas cálidas, por ejemplo. Sin embargo, permitir que los vinos realicen la FML antes del embotellado aumenta la estabilidad. El AL ayuda a aumentar la acidez del vino al prolongar la percepción sensorial de acidez (Carvalho et al., 2001).
La adición de ácido láctico al vino tiene tres ventajas: se puede añadir justo antes del embotellado sin riesgo de precipitación; produce una sensación en boca más redonda y suave que el ácido málico; y le da al vino un sabor dulce.
Al ser el ácido más débil permitido por la OIV para la acidificación del vino, el AL debe añadirse en mayores cantidades para conseguir la misma disminución del pH que los ácidos málico o tartárico.
4. Ácido cítrico
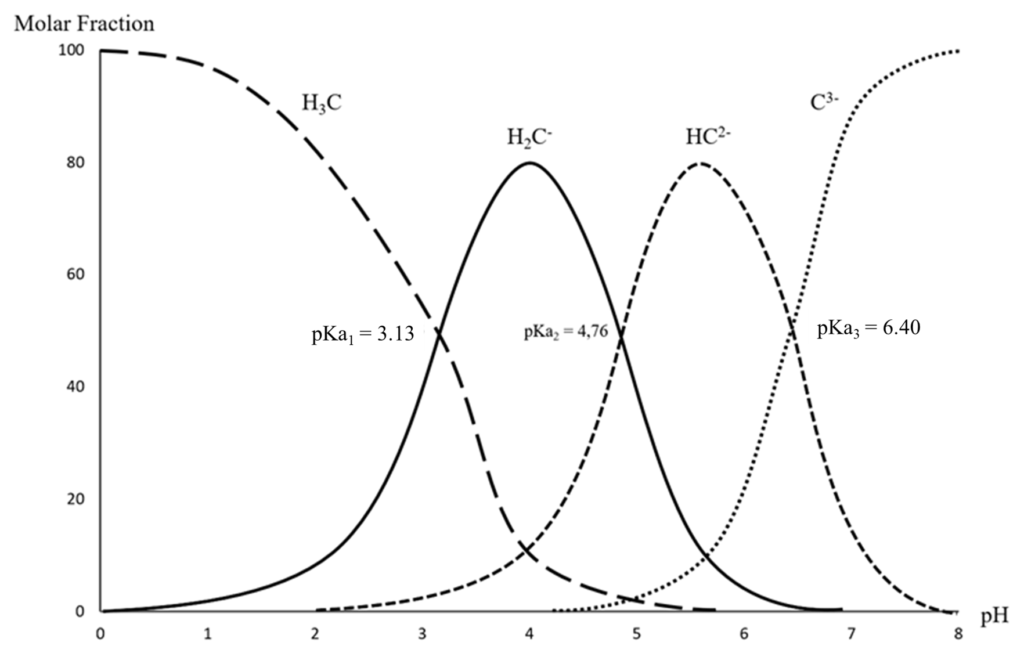
El ácido 2-hidroxipropano-1,2,3-tricarboxílico, también conocido como ácido cítrico (CA) (Figura 1), es un ácido triprótico, cuyos pKa a 25 °C son 3,13, 4,76 y 6,40 (Figura 5) (Lide et al., 2005). El AC es un ácido que se encuentra naturalmente en muchas frutas y verduras, especialmente en frutas tipo cítrico. Es un ácido débil que se utiliza a menudo como conservante natural en muchos alimentos (E330) o para añadir un sabor amargo a bebidas o alimentos. El AC es un metabolito muy importante en el ciclo de Krebs (Ribéreau-Gayon et al., 2012).
En el vino, el AC se encuentra normalmente en cantidades dentro del intervalo de 0,1 a 0,7 g/L. Las bacterias del vino utilizan AC para su metabolismo. Primero se degrada en ácido acético y ácido pirúvico (Shimazu et al., 1985), y luego el ácido pirúvico se metaboliza formando ácido láctico y una fracción de diacetilo, acetoína y 2,3-butanodiol. Un aumento de la concentración de AC se correlaciona con un aumento de la concentración de diacetilo. El AC puede ayudar a los antioxidantes quelando iones metálicos y ayudando así a prevenir el pardeamiento (Jiang y Fu, 1998).
La OIV sólo permite la adición de AC en el mosto para prevenir la quiebra férrica; el residuo restante no debe superar 1 g/L (Zoecklein, 2012). Cuando se añade al vino, el AC realza el sabor de muchos vinos blancos y, al mismo tiempo, contribuye a darle un carácter cítrico. La principal desventaja de este ácido es su inestabilidad microbiana, ya que aumenta el crecimiento de microorganismos no deseados en el vino. Las BL pueden metabolizar el ácido cítrico para formar ácido acético y diacetilo (Capozzi et al., 2021; Sumby et al., 2019).
5. Ácido fumárico
El ácido fumárico (Figura 1), ácido (2E)-pero-2-enodioico, es un ácido diprótico cuyos pKas a 25 °C son 3,02 y 4,38 (Figura 6) (Lide et al., 2005). El ácido fumárico (AF) originalmente deriva su nombre de la planta Fumaria officinalis, de la cual se aisló este ácido orgánico por primera vez (Roa Engel et al., 2008). El AF es un metabolito intermediario en el ciclo del ácido cítrico y se convierten en ácido L-málico mediante la acción de la enzima fumarasa (Akiba et al., 1984; Pines et al., 1996). Debido a su bajo peso molecular, 116,073 g/mol, El AF tienen una mayor capacidad tampón que otros ácidos de calidad alimentaria a un pH de alrededor de 3,0.
El AF es el más barato de los ácidos de calidad alimentaria y no es tóxico; se ha utilizado como agente antibacteriano y acidulante en la industria de alimentos y jugos desde 1946 (Das et al., 2016; Straathof y van Gulik, 2012). Está clasificado como aditivo alimentario distinto de edulcorantes y colorantes con el número E E297 según el Reglamento de la Comisión de la Unión Europea N° 1129/2011. Tiene un sabor parecido a la fruta.
Debido a su grupo dicarboxílico, El AF tienen un alto poder acidificante. Está presente de forma natural en pequeñas cantidades tanto en las uvas tintas como en las blancas (de 5,11 a 10,69 mg/L) (Eyduran et al., 2015; García Romero et al., 1993). Además de la reducción del pH, el AF se pueden utilizar por sus propiedades antibacterianas, que se han demostrado en diferentes alimentos y bebidas, como verduras procesadas sin calor, sidra de manzana inoculada con E. coli y carne molida envasada al vacío (Comes y Beelman). , 2002; Lu et al., 2011; Podolak et al., 1996). El AF también tienen propiedades antifúngicas (Akao y Kuroda, 1991).
Debido a su capacidad para reducir el pH, el AF también limita el desarrollo y crecimiento bacteriano (Gurtler y Mai, 2014). Cuando se adiciona antes de la FML, no solo disminuye el pH sino que también inhibe la actividad de las BL al afectar a la biosíntesis de pirimidinas (Cofran y Meyer, 1970; Pilone et al., 1974; Silver y Leighton, 1982); esto se observó cuando se añadió AF en cantidades de entre 0,4 y 1,5 g/L después de la fermentación alcohólica (Bauer y Dicks, 2004). Más recientemente, se ha demostrado que el AF inhibe completamente el crecimiento de O. Oeni en cantidades de 0,3 a 0,6 g/l a un pH de 3,3 (Morata et al., 2019). Un estudio sobre la adición de AF a diferentes variedades ha demostrado que tiene un efecto duradero sobre O. Oeni y, por tanto, podría ser una solución más permanente que la adición clásica de SO2 (Morata et al., 2023).
Ough (1963) describió el umbral de AF en el vino blanco como 1 g/L, que es el umbral más bajo en comparación con el ácido tartárico y cítrico. El umbral sensorial del AF en el vino tinto es de alrededor de 1387 mg/L (Gancel et al., 2022). El AF se perciben como más ácido que el ácido cítrico y el ácido málico (Buechsenstein y Ough, 1979). Un estudio reciente ha demostrado que en concentraciones de 0,6 g/L el AF mejora la percepción de acidez y cuerpo del vino (Morata et al., 2019).
Sin embargo, puede resultar complicado trabajar con el AF, ya que es muy difícil disolverlo en agua, puesto que tiene una solubilidad inferior a 10 g/l (Yang et al., 2011). La solubilidad del AF en el vino es de alrededor de 15 g/l a 25 °C, lo que lo convierte en uno de los ácidos orgánicos menos solubles en el vino en comparación con el ácido tartárico, málico y cítrico (respectivamente 1049,3 g/l, 1047,0 g/l, 1079,7 g/l). L) (Gancel et al., 2022).
El AF en concentraciones de hasta 3 g/L ya están permitidos para la acidificación del vino en países como Estados Unidos, Canadá y Chile (Smith y Hong-Shum, 2008). La OIV ha adoptado una nueva resolución para autorizar la adición de AF en el vino (300 a 600 mg/L) para prevenir la FML (OIV-OENO 581A-2021). Aún no se ha permitido su uso con fines de acidificación en los países miembros de la OIV.
Acidificación física
Como se vio en el apartado anterior, la adición de ácidos orgánicos al vino para reducir su pH es hoy en día una práctica común. Sin embargo, puede resultar complicado controlar esta reducción del pH, así como superar los efectos adversos y las dificultades de trabajar con ácidos orgánicos, como la precipitación del ácido tartárico, el riesgo de una segunda FML si se utiliza ácido málico o la dificultad para disolver el ácido fumárico. Se han desarrollado muchos métodos de acidificación física que pueden utilizarse como alternativas a algunas prácticas enológicas tradicionales.
1. Resinas de intercambio iónico
El uso de resinas de intercambio catiónico es una opción disponible para reducir simultáneamente el pH, disminuir la concentración de cationes y restringir la formación de sales de tartrato (Esau y Amerine, 1966; Mira et al., 2006).
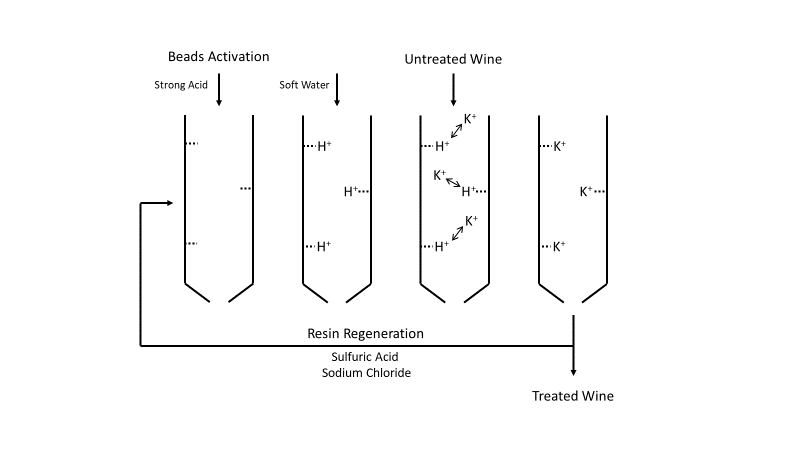
La acidificación mediante resinas de intercambio iónico es un proceso que consiste en tratar el vino a través de un medio granular insoluble polimerizado con el fin de intercambiar iones positivos o negativos. Este medio está compuesto por una matriz polimérica de estireno y divinilbenceno, a la que se unen diferentes grupos funcionales ionizados (ácido carboxílico o ácido sulfónico para resinas ácidas y varios tipos de grupos amino para intercambiadores básicos). Existen tres técnicas diferentes que utilizan resinas de intercambio iónico:
I) el uso de una resina de intercambio catiónico a partir de la cual los protones (H+) reemplazan los iones potasio en el vino,
II) el uso de una resina de intercambio aniónico a partir de la cual se intercambia el ion tartrato por hidroxilo (OH-), y
III) el uso de una mezcla de ambas resinas, intercambiándose tanto los iones potasio como el tartrato por H+ y OH-, de manera que el bitartrato de potasio se cambia por agua.
Según la resolución 442/2012 y 443/2012 de la OIV y el reglamento UE 144/2013, sólo el primer método que utiliza la resina de intercambio catiónico está autorizado como método alternativo para acidificar los vinos.
En el método de intercambio catiónico, se utiliza una potente solución ácida, como ácido sulfúrico o clorhídrico, para activar las perlas de resina durante el tratamiento estándar del vino. Luego se enjuagan las perlas con agua blanda y se hace pasar el vino. A medida que el vino pasa por la columna, los iones de hidrógeno (H+) de las resinas se intercambian con cationes del vino, como el potasio K+. Este intercambio conduce a una reducción de la concentración de cationes y del pH del vino, y también reduce el riesgo de precipitación de ácido tartárico mediante la formación de sales de tartrato (KTH) (Benı́tez et al., 2002; Ibeas et al., 2015; Lasanta et al. , 2013; Mira et al., 2006; Palacios et al., 2001; Walker et al., 2004). 1xBet is a preferred choice for Indian bettors because of its extensive variety of betting options. The 1xBet promo code for today you get to claim a welcome bonus up to €1950 + 150 free spins on casino and 130% up to €130 on sports. These codes can also be used to bet on other major tournaments such as the Premier League, La Liga, Champions League, and more. To use the 1xBet promo code, start by filling in the registration form on the website. You can choose from multiple sign-up options: One-Click, Phone, Email, or Social Media. If you choose the One-Click method.
El uso de resinas de intercambio catiónico en la elaboración de vino tinto es una herramienta útil para disminuir el pH, así como para mejorar la estabilidad tartárica. Sin embargo, su uso puede resultar problemático debido a la fuerte afinidad de la matriz de estireno-divinilbenceno por los antocianos y los polifenoles (Ibeas et al., 2015; Lasanta et al., 2013; Mira et al., 2006). Se ha descubierto que el tratamiento de intercambio catiónico del vino tinto produce una ligera disminución de antocianos y taninos, así como una disminución de la tonalidad y un aumento de la intensidad colorante, probablemente debido a la disminución del pH del vino. Sin embargo, se observó que el tratamiento tiene poco impacto sobre los compuestos volátiles, y se vio que los vinos tratados utilizando intercambiadores catiónicos tenían una mayor calidad general durante la cata (Lasanta et al., 2013).
Las resinas de intercambio catiónico han sido estudiadas por su potencial para acidificar los vinos blancos. En el estudio de Just-Borràs et al. (2022), el vino base utilizado para producir vino blanco espumoso fue tratado con resina de intercambio catiónico, lo que dio lugar a una disminución significativa del pH y a un aumento de la acidez titulable. Cisilotto et al. (2019) se centraron en el mosto Chardonnay, que se trató con resina de intercambio catiónico y se fermentó para producir vinos con un pH más bajo de 3,15 (control) a 2,97. Los resultados mostraron una mejora en la estabilidad oxidativa de los vinos tratados y cambios significativos en la concentración de varios compuestos volátiles, que podrían afectar a las propiedades sensoriales de los vinos.
Después del tratamiento, las resinas de intercambio catiónico se pueden regenerar utilizando soluciones concentradas de ácido sulfúrico y cloruro de sodio (Ribéreau-Gayon et al., 2012). Sin embargo, este proceso requiere una cantidad significativa de agua y los efluentes resultantes deben tratarse y reciclarse como desechos especiales, lo que significa que la tecnología es bastante costosa para el medio ambiente e insostenible.
2. Electrodiálisis
La electrodiálisis es un proceso electroquímico que mueve iones disueltos de una solución a otra con la ayuda de un potencial eléctrico. La diferencia entre la electrodiálisis y un proceso de intercambio clásico es que la electrodiálisis utiliza membranas semipermeables selectivas de iones para segregar los iones en función de su carga. Hay tres tipos de membranas de intercambio iónico utilizadas en electrodiálisis: membranas de intercambio aniónico, membranas de intercambio catiónico y membranas bipolares.
Las membranas de intercambio iónico son delgadas y densas, y tienen paredes insolubles compuestas de material polimérico permeable a los iones, mientras que las membranas catiónicas y aniónicas solo son permeables a cationes y aniones respectivamente (El Rayess y Mietton-Peuchot, 2016). Las membranas catiónicas están compuestas de copolímeros de estireno-divinilbenceno con grupos funcionales sulfónicos (SO32-), mientras que las membranas aniónicas están hechas de copolímeros de estireno-divinilbenceno funcionalizados con amonio cuaternario (NR4+) (OIV, 2017). Las membranas bipolares comprenden una membrana de intercambio catiónico laminada con una membrana de intercambio aniónico, a través de la cual los cationes o aniones no pueden penetrar.
La electrodiálisis se utilizó por primera vez en enología para la estabilización tartárica del vino (Escudier et al., 1993). El principio de la electrodiálisis para la estabilización del tartrato se basa en la migración de aniones (como TH- y T-) hacia los electrodos positivos (ánodo), mientras que los cationes (K+) son atraídos hacia el electrodo negativo (cátodo) bajo la influencia de un campo eléctrico.
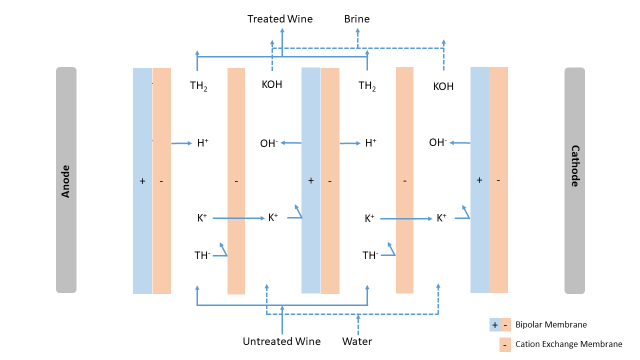
La electrodiálisis con membranas bipolares (EBM) permite ajustar con precisión el pH del mosto o del vino con una precisión de 0,05 unidades, independientemente del pH inicial, sin alterar los contenidos de ácido tartárico y málico ni los compuestos de la matriz del vino (como alcohol, aromas y polifenoles). La EBM se puede utilizar tanto para la acidificación como para la desacidificación; cuando se usan para acidificación, las membranas bipolares se acoplan con membranas catiónicas (Figura 7).
El proceso de acidificación del vino mediante electroerosión implica la circulación del vino dentro de un paquete de membranas, lo que le permite fluir entre las membranas catiónicas y el lado catiónico de las membranas bipolares. El agua fluye en un compartimento adyacente. Al aplicar un campo eléctrico, los iones potasio se desplazan hacia el cátodo, atraviesan las membranas catiónicas y se extraen del vino, concentrándose en el agua, que se transforma en salmuera. Dentro del compartimento del vino, el potasio es reemplazado por protones (H+) formados en la unión de la membrana bipolar. De manera similar, los iones bitartrato tienden a moverse hacia el ánodo, pero se les impide cruzar la capa catiónica de la membrana bipolar y, por tanto, permanecen en el vino. Como resultado, el vino conserva el bitartrato (y las bases conjugadas de otros ácidos orgánicos) y se enriquece con iones H+, lo que provoca una disminución del pH y un aumento de la acidez total.
Se ha observado que los tratamientos con EBM tienen efectos positivos en la composición del vino, como por ejemplo la mejora del equilibrio de la fracción ácida, particularmente en comparación con la adición de ácido tartárico. Los vinos tratados con EBM se perciben más frescos y ligeros en boca en comparación con los productos no tratados. Además, los vinos tratados no presentan la sensación áspera en boca que comúnmente se asocia a la adición de ácido tartárico (Moutounet et al., 2005). Otros parámetros clásicos, como los azúcares del mosto, el contenido de alcohol y los compuestos polifenólicos, no se ven afectados por el tratamiento con EBM (Granès et al., 2008). Sin embargo, esta técnica implica un consumo importante de agua (Halama et al., 2015).
Acidificación microbiológica
Se pueden aplicar enfoques microbiológicos para hacer frente a la baja acidez del vino. El uso de cepas de S. cerevisiae es una de esas opciones, ya que pueden producir pequeñas cantidades de ácido málico, láctico o succínico. Otro enfoque es el uso de L. thermotolerans, que pueden aumentar los niveles de ácido láctico en varios gramos por litro y reducir el pH en varias unidades decimales. S. bacillaris, por otro lado, puede generar ácido α-cetoglutárico y ácido pirúvico, mientras que C. stellata es conocida por producir cantidades significativas de ácido succínico.
1. Saccharomyces
Múltiples métodos biológicos pueden mejorar la acidez del vino. El género Saccharomyces es capaz de aumentar la acidez aumentando la concentración de ácido málico o láctico, normalmente por debajo de 1 g/l para las cepas naturales. Aunque las cepas Saccharomyces modificadas genéticamente pueden afectar sustancialmente la acidez, su uso está restringido por normativa en la mayoría de los países (Benito, 2019; Maicas, 2021).
Algunas cepas de S. cerevisiae pueden producir pequeñas cantidades de ácido málico (menos de 1 g/L) durante la fermentación alcohólica (Su et al., 2014; Yéramian et al., 2007). Normalmente, las cepas de S. cerevisiae que se originan en regiones cálidas mantienen o incluso aumentan los niveles de ácido málico durante la fermentación, mientras que las de regiones frías tienden a consumirlo. La producción de ácido málico también está influenciada por diversas condiciones de fermentación, incluyendo baja temperatura, alto pH y bajo nivel de azúcar.
Además, concentraciones más altas de piruvato y fumarato pueden provocar niveles elevados de ácido málico al final de la fermentación. Recientemente, una selección de cepas de S. cerevisiae fue capaz de producir hasta 3 g/l de ácido málico (Vion et al., 2023). Por el contrario, algunas cepas seleccionadas de Saccharomyces, como S. paradoxus y S. pombe, fueron capaces de degradar hasta un 40% del ácido málico (Redzepovic et al., 2003).
S. cerevisiae puede generar pequeñas cantidades de ácido láctico durante la fermentación alcohólica (Dequin et al., 1999). No obstante, la producción de ácido láctico por cepas de S. cerevisiae es muy limitada y tiene un impacto insignificante en la acidez total general, a menos que se utilicen cepas modificadas genéticamente.
El género Saccharomyces tiene el potencial de producir varios ácidos orgánicos, además de los ácidos málico, acético y láctico, que pueden afectar a la acidez total del vino (Volschenk et al., 2017). Los ácidos succínico, α-cetoglutárico, pirúvico y fumárico se encuentran entre los principales ácidos orgánicos liberados por el género Saccharomyces durante la producción de vino. Estos ácidos son intermedios o subproductos del ciclo del TCA o de la glucólisis (Chidi et al., 2015).
2. Lachancea thermotolerans
Lachancea thermotolerans, anteriormente conocida como Kluyveromyces thermotolerans, es una levadura no Saccharomyces que se utiliza comúnmente en la elaboración de vinos, especialmente para la producción de vinos blancos. L. thermotolerans ha sido objeto de gran atención en los últimos años como herramienta potencial para la acidificación en la elaboración del vino (Morata et al., 2018; Porter et al., 2019). Un estudio reciente destacó la diversidad genética y la adaptabilidad de L. thermotolerans, lo que sugiere que podría usarse en una gran variedad de contextos vitivinícolas (Hranilovic et al., 2017).
Los primeros estudios sobre la acidificación del vino utilizando L. thermotolerans se han llevado a cabo en los países mediterráneos Grecia e Italia, que son regiones vitivinícolas afectadas por el cambio climático (Benito, 2018b; Vicente et al., 2021). Un estudio sobre vinos blancos de zonas cálidas muestra que el uso de L. thermotolerans puede reducir eficazmente el pH y al mismo tiempo mejorar la frescura y los perfiles aromáticos de los vinos (Vaquero et al., 2020).
Debido a su capacidad para elevar la concentración final de ácido láctico en el vino en varios gramos por litro, influyendo significativamente en su acidez y pH, L. thermotolerans se ha convertido en el enfoque biológico más seguro para acidificar el vino (Vicente et al., 2021). L. thermotolerans tiene una capacidad acidificante de 1 a 9 g/L en ácido láctico y de 1 a 6 g/L en acidez total (Benito, 2018b). El ácido L-láctico producido durante la fermentación alcohólica induce una reducción del pH, que puede variar de 0,1 a 0,5 unidades. Diversos estudios científicos hanmostrado que L. thermotolerans produce menores cantidades de ácido acético que los vinos control fermentados con S. cerevisiae. Normalmente, la concentración de ácido acético generado por L. thermotolerans es inferior a 0,2 g/L (Benito, 2018b; Vilela, 2018).
Aunque L. thermotolerans tiene una ventaja competitiva significativa porque aumenta la acidez del vino, también existen limitaciones para su uso. L. thermotolerans tiene un poder fermentativo moderado, siendo incapaz de fermentar etanol en concentraciones superiores al 9-10 % (v/v). Por tanto, es necesario combinarlo con una levadura más fermentativa. En uno de los primeros estudios sobre el tema, se investigó el uso de L. thermotolerans y S. cerevisiae en cofermentación como estrategia para potenciar la acidez y mejorar la calidad general del vino (Gobbi et al., 2013). Para asegurar la fermentación total de los azúcares en el mosto se pueden utilizar géneros como Saccharomyces o Schizosaccharomyces en combinación con L. thermotolerans (Benito, 2020).
Otro estudio ha mostrado que L. thermotolerans puede influir significativamente en la evolución de la FML tanto en vinos blancos como tintos, dependiendo de la producción de ácido láctico (Snyder et al., 2021). L. thermotolerans tiene una resistencia limitada al anhídrido sulfuroso, generalmente sólo tolera hasta 20 mg/L de anhídrido sulfuroso libre, aunque algunas cepas pueden tolerar hasta 40 mg/L (Benito, 2018a, 2018b; Vicente et al., 2021). Por lo tanto, es más adecuado para uvas con buenas condiciones sanitarias y bajos requerimientos de SO2.
3. Otros no Saccharomyces
Además de las levaduras convencionales, determinadas cepas no convencionales también pueden resultar útiles para acidificar el vino. Candida zemplinina, anteriormente conocida como Starmerella Bacillaris, es una levadura que se descubrió inicialmente en las uvas de vino Tokaj y que a menudo se encuentra en uvas demasiado maduras o botritizadas (Ciani et al., 2016).
C. Zemplinina es conocida por su capacidad para producir ácido pirúvico en condiciones anaeróbicas, ya que prefiere la vía glicerol-pirúvica. Algunas cepas de C. Zemplinina pueden generar hasta 100 mg/L de ácido pirúvico, mientras que los controles de S. Cerevisiae normalmente producen sólo alrededor de 20 mg/L. Esto sugiere que, en condiciones de bajo oxígeno, C. Zemplinina genera varios ácidos orgánicos a través del ciclo del TCA (Goold et al., 2017; Magyar et al., 2014).
Debido a la reducción del pH, el uso de C. Zemplinina también puede influir en el color del vino. Además, el ácido pirúvico puede reaccionar con los antocianos para producir piroantocianinavitisina, un pigmento colorante muy estable resultante de la oxidación del vino (Romboli et al., 2015). Además, C. Zemplinina es conocida por producir niveles bajos de ácido acético. En un enfoque de coinoculación con S. Cerevisiae, el contenido de ácido acético resultante fue 0,3 g/L menor que en el control puro de S. Cerevisiae (Rantsiou et al., 2012).
Según Englezos et al. (2018), cuando se utilizaron C. Zemplinina y S. Cerevisiae en fermentaciones combinadas de cuatro mostos de uva blanca diferentes, las concentraciones de acidez total resultantes fueron mayores que las obtenidas con los controles puros de S. Saccharomyces. Un enfoque de fermentación secuencial con C. Zemplinina y Saccharomyces Cerevisiae dio como resultado un contenido de alcohol más bajo y una mayor acidez total que todas las fermentaciones con solo Saccharomyces, así como fermentaciones secuenciales que usaron L. thermotolerans, Torulaspora delbrueckii y Metschnikowia fructicola (Castrillo et al. ., 2019; Comitini et al., 2011).
Conclusiones
La técnica de acidificación más utilizada, la acidificación química, es bien conocida y hay múltiples opciones disponibles.
Los enólogos utilizan ampliamente el ácido tartárico para reducir el pH y aumentar la acidez total. Sin embargo, el uso de ácido tartárico puede provocar la precipitación de la sal tartrato y, si se añade en concentraciones demasiado altas, su uso puede dar lugar a un vino desequilibrado y áspero.
Cuando se añade al vino, el ácido málico aumenta la acidez y la frescura de los vinos jóvenes; sin embargo, al ser un buen sustrato para las BL, su uso no es aconsejable para ajustar el pH.
El ácido láctico, por el contrario, produce vinos más redondos y suaves. Al ser el ácido más débil permitido por la OIV para la acidificación del vino, es necesario añadirlo en mayores cantidades para obtener la misma disminución del pH que con el ácido málico o tartárico.
Si bien el ácido cítrico mejora el sabor de los vinos blancos, no es microbiológicamente estable y su uso conlleva un alto riesgo de producir compuestos no deseados como el ácido acético.
El ácido fumárico es un agente acidificante prometedor, ya que tiene el mayor poder acidificante de todos los ácidos orgánicos antes mencionados. Su uso ya está permitido por la OIV para prevenir la FML.
Si bien la adición de ácidos orgánicos es una práctica común para reducir el pH del vino, se han desarrollado métodos de acidificación física como las resinas de intercambio iónico y la electrodiálisis con membranas bipolares como alternativas a las prácticas enológicas tradicionales.
Las resinas de intercambio catiónico se utilizan para tratar el vino mediante el intercambio de iones para reducir el pH, disminuir la concentración de cationes y restringir la formación de sales de tartrato. Sin embargo, el uso de resinas de intercambio catiónico puede provocar algunos problemas, como la reducción del color y los taninos en los vinos tintos.
La electrodiálisis con membrana bipolar, por otro lado, utiliza membranas semipermeables selectivas de iones para segregar los iones en función de su carga. La electrodiálisis ha demostrado ser eficaz para reducir el pH del vino sin alterar los parámetros enológicos clásicos y mejorar sus propiedades organolépticas, haciéndolo más fresco y ligero en boca. Sin embargo, ambas técnicas tienen impactos ambientales a causa de la necesaria regeneración de resinas y el alto consumo de agua.
Por último, existen varios enfoques microbiológicos para resolver la baja acidez del vino. Las cepas de Saccharomyces, como S. cerevisiae, pueden producir bajas cantidades de ácidos orgánicos, incluidos ácido málico, láctico y succínico, mientras que Lachancea thermotolerans es una levadura no Saccharomyces que puede aumentar los niveles de ácido láctico y reducir el pH en varias unidades decimales. Otras cepas no Saccharomyces, como Candida zemplinina, también pueden producir ácidos orgánicos que pueden afectar a la acidez total del vino.
La elección de las cepas de levadura para la fermentación del vino depende de varios factores, entre ellos la variedad de uva, el clima y el estilo de vino deseado. Por tanto, estos enfoques microbiológicos pueden proporcionar a los enólogos herramientas útiles para controlar la acidez del vino y mejorar la calidad del vino.
Fuente: Infowine