El ácido tartárico y sus sales son utilizados en la elaboración del vino y en otros alimentos como acidulante, controlador del pH, conservante, emulsionante, agente quelante, potenciador y modificador del sabor, estabilizador, agente antiaglomerante y agente reafirmante. Para entender su química y aplicaciones, el médico francés Louis Pasteur (1822-1895), también inventor del proceso de pasteurización, junto a su colega galo Jean Baptiste Biot (1774-1862) desarrollaron y aplicaron el concepto de quilaridad molecular, o sea la particularidad de que algunas moléculas tienen una función determinada mientras que su par o imagen especular son capaces de producir efectos muy diferentes.

Por Miguel Pocoví. Doctor en Ciencias y catedrático de Bioquímica y Biología Molecular
El ácido tartárico o ácido tártrico (ácido 2,3-dihidroxibutanodioico, fórmula molecular C4H6O6), es un ácido dicarboxílico que constituye un acidificante y conservante natural (clasificado en el Código Alimenticio europeo con el no. 334). El interés por este ácido probablemente sería insignificante si no fuera por el hecho de que es el principal ácido encontrado en la vitis vinífera, el que aporta acidez y amargor a los vinos.
Los antiguos griegos y romanos conocían el ácido tartárico como un subproducto de la elaboración del vino; sin embargo, no aprovechaban su uso porque el vino no se almacenaba en toneles de madera o recipientes adecuados que permitieran sedimentar el tartárico. Cuando se utilizaron los toneles de madera para la recolección de vino, se empezó a obtener el tártaro crudo. En el siglo XVI, Teofrasto Paracelso identificó el uso del tártaro como medicamento, pero no se conocía la sustancia química, se tuvo que esperar a la primera mitad del siglo XVIII para aislarlo por primera vez.
El ácido tartárico, aparte de ser el ácido más abundante del vino, también es el más estable, pudiendo llegar a suponer los dos tercios del total de sus ácidos orgánicos. Junto con el ácido málico (ácido hidroxibutanodióico) representa cerca del 90% de los ácidos del mosto, siendo sintetizado tanto en las hojas y como en los racimos.
Curiosamente, sólo unas pocas especies de frutos, aparte de las uvas, como son el aguacate, tamarindo, lichi, cereza dulce, arándano, algunos cítricos y el plátano contienen niveles significativos de este ácido, lo cual resulta extraño a pesar de su estrecha similitud estructural con muchos otros ácidos dicarboxílicos de 4 carbonos, abundantes en plantas.
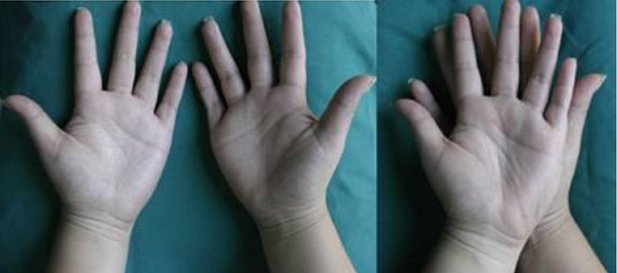
Cuando nos referimos al ácido tartárico, tenemos que aclarar que hay distintos tipos de este ácido, que a pesar de tener la misma fórmula y el mismo número de átomos de carbono, oxígeno e hidrógeno, difieren en su distribución espacial y propiedades. Lo mismo ocurre con determinados objetos que parecen idénticos, pero cuando los observamos en tres dimensiones no lo son, ya que en realidad son imágenes especulares, por ejemplo, nuestra mano derecha y nuestra izquierda (Figura 1).
Las manos de un individuo no se pueden superponer una encima de la otra, y decimos que son quirales. El término quiralidad deriva del griego “keir” (mano), y describe el hecho que algunas figuras o cuerpos no son superponibles a su imagen en un espejo. Dos objetos pueden ser quirales, sin importar la escala en la que se produce el fenómeno. Si el objeto es superponible a su imagen especular, se dice que es aquiral, por ejemplo dos bolas blancas del mismo diámetro se pueden superponer, por lo tanto serán aquirales. La imagen especular no superponible de un objeto se le denomina enantiómero; visto de esta manera cada mano es enantiómera, una respecto a la otra. La quiralidad de los objetos macroscópicos era reconocida y discutida desde la Antigua Grecia.
Lo mismo ocurre con las moléculas: en determinados casos es necesario tener en cuenta su estructura tridimensional. Dos moléculas con los mismos átomos y misma conectividad (mismos enlaces) pueden ser quirales y sus enantiómeros tener propiedades físicas y químicas diferentes. La quiralidad constituye un elemento central de la química, la física y la biología.
Es probable que hayamos oído hablar de los «diamantes de vino», pero también es posible que no sepamos la contribución que el ácido tartárico ha hecho al avance científico. El ácido tartárico, mejor dicho las sales del ácido tartárico, fueron las primeras moléculas quirales, cuya mezcla de enantiómeros se consiguió separar.
Louis Pasteur, Jean Baptiste Biot y el descubrimiento de la quilaridad molecular
Al comprar leche o queso, uno puede ver la indicación que en muchos casos dice “leche pasteurizada”, y ahí seguramente nos acordamos que fue el químico, físico y biólogo francés Louis Pasteur (1822-1895) quien desarrolló este proceso, conocido como pasteurización, que permite eliminar los gérmenes de un producto elevando su temperatura durante un corto período de tiempo. También, ahora con las vacunas contra el covid 19, nos acordamos de él por ser quien desarrolló vacunas contra la rabia y el ántrax.
Pero quizás no sepamos que, en sus inicios, Pasteur fue un artista, mostrando una aptitud por la pintura y siendo reconocido por sus retratos. Su primera ambición fue la de ser profesor de arte. Pero a instancias de su padre, se convirtió en científico. Sin sus primeras exploraciones creativas, es posible que no hubiera hecho uno de sus descubrimientos científicos más monumentales, y que menos se comenta, un descubrimiento con implicaciones de gran alcance, que fue el demostrar que existen algunas moléculas en formas de imagen especular, capaces de producir efectos muy diferentes. Actualmente vemos los efectos de la quiralidad en la química y en nuestro cuerpo, incluso en los medicamentos que tomamos.
Pasteur conocía que durante la elaboración del vino, una sustancia llamada ácido tartárico se acumulaba en forma de costra o tártaro en las paredes de las piletas o en los tapones. Esta sustancia había sido aislada en 1769 por el químico sueco Carl Wilhelm Scheele, quien le dio en nombre de ácido tartárico, En los siglos XVIII y XIX, este ácido era utilizado por los fabricantes de tintes y medicinas.
En 1832, el físico, astrónomo y matemático francés Jean Baptiste Biot (1774-1862) había observado una curiosa propiedad del ácido tartárico, que era que las disoluciones del mismo hacían rotar la luz polarizada. Biot había inventado un instrumento llamado polarímetro, que consistía en dirigir un rayo de luz polarizada a través de determinadas disoluciones, especialmente los azúcares, y que permitía medir la desviación del plano de la luz polarizada. Biot observó que con este instrumento podía determinar las concentraciones de disoluciones de azúcar y se lo denominó sacarímetro. Además Biot formuló una ley simple:
a = [a0] T,l .L. c
donde, medida en grados, a es la desviación observada del plano de la luz; [a0] es la desviación específica del compuesto estudiado; L la longitud en decímetros del recipiente que es penetrado por la luz, que contiene la muestra en solución y su concentración en g/mL. [a0] se ajusta a la temperatura T y de la longitud de onda l y, además, la naturaleza del disolvente debe también precisarse.
Dado que la variación de la desviación se puede relacionar fácilmente con la concentración de una determinada sustancia, el polarímetro puede calibrarse y emplear para determinar la concentración de un producto en una muestra de composición desconocida. Estos sacarímetros constituyeron, un gran avance en medicina para analizar el contenido de azúcar en la orina de los diabéticos. Y a esta ley de Biot y al instrumento que constituye, se la sigue utilizando para determinar la glucosa en viticultura y enología.
Biot hacía campaña a favor de la aplicación de la física óptica a la química, pero durante demasiado tiempo no fue escuchado. Pasteur conocía bien el trabajo pionero de Biot sobre el efecto rotatorio óptico de las moléculas orgánicas. Pasteur utilizó el polarímetro que había inventado Biot, un microscopio y la hipótesis de trabajo -que era que la simetría de las moléculas era lo que causaba esta rotación-, para identificar la causa molecular que producía este efecto en la luz. Previamente Pasteur también se había dado cuenta de que ciertos cristales de cuarzo hacen girar a la derecha el plano de la luz polarizada, y otros, a la izquierda; sustancias orgánicas tales como el azúcar en disolución giraban a la derecha el plano de polarización de la luz, y otras como la quinina o la esencia de trementina lo desviaban hacia la izquierda.
Cuando se hervía el vino durante mucho tiempo se producía una sustancia que se denominaba ácido paratartárico. Este ácido desconcertaba a los químicos de la época. Berzelius (1779-1848) se había dado cuenta que tenía el mismo peso atómico que el ácido tartárico y la misma composición molecular, pero difería en la solubilidad. Gay Lussac (1778-1850), lo comparó con el ácido tartárico y descubrió que tenía propiedades bioquímicas idénticas, propuso denominarlo ácido racémico (del latín racemus, racimo de uvas).
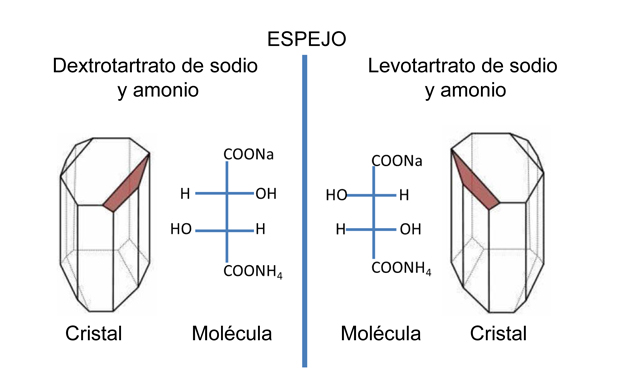
En 1848, Pasteur llevó a cabo un estudio sistemático de los cristales de las sales sódicas y amónicas de los ácidos tartárico y paratartárico, las examinó cuidadosamente con un microscopio y las separó con pinzas, buscando una relación entre la diferencia de polarización de ambos cristales y su eventual asimetría. Pasteur observó que una de las caras de los cristales del tartrato sódico amónico era más alargada, lo que les da una forma asimétrica comparable a los cristales de cuarzo. Al observar bajo el microscopio los cristales de la sal sódica y amónica del ácido racémico (ácido paratartárico), éstos eran de dos formas, una de ellas idéntica a los cristales del tartrato sódico y amónico y la otra resultaba ser idéntica a su imagen en un espejo (Figura 2).
Pasteur consiguió separar un número suficiente de los distintos tipos de cristales y preparó una solución con cada tipo aislado. Los cristales derechos, idénticos por completo a los de ácido tartárico, desviaban la luz polarizada a la derecha, los cristales izquierdos lo hacían a la izquierda. Una disolución con proporciones iguales de las dos formas de cristales no desviaba el plano de polarización de la luz, es decir la disolución se comportaba como neutra (Figura 2). Pasteur acababa de descubrir la quilaridad molecular. Descubrimiento hecho por un hombre que quería ser artista, pero se conformó con ser científico.
Pasteur, tras este hallazgo, envió una carta al prestigioso Jean Baptiste Biot, a quien no conocía en ese momento, pidiéndole entrevistarse con él para mostrarle su experimento. Biot aceptó y le propuso repetir el experimento en su laboratorio para poder supervisarlo.
¡Muchacho, he amado tanto la ciencia durante mi vida, que esto me toca el corazón!».
Frase atribuida al científico Jean Baptiste Biot, dicha a Louis Pasteur en reconocimiento por haber comprobado sus teorías con experimentos de laboratorio.
Para entonces, se decía que Biot, a sus 74 años, era bastante misántropo y demasiado crítico. Ser elogiado por él era raro; sus diatribas eran más comunes. Pero Pasteur nunca conoció ese lado de él, porque desde ese momento, había despertado en el viejo Biot el ansia de ver la obra de su vida llevada a cabo por un joven sabio. Ambos científicos, a partir de 1848, mantuvieron una correspondencia regular. Biot fue el principal patrocinador de Pasteur, lo dio a conocer en Francia y Alemania; le presentó a personajes ilustres tales como el novelista Alexandre Dumas, al químico y farmacéutico Louis Jacques Thénard, al profesor de química Théophile-Jules Pelouze, y al cristalógrafo alemán Eilhard Mitscherlich. Biot y Pasteur mantuvieron una estrecha amistad, como lo demuestra el hecho de que Biot era el padrino de su segundo hijo, que le puso el nombre de Biot, Jean-Baptiste.
En 1853, Pasteur fue capaz de separar las dos formas de una muestra racémica de ácido tartárico, esta vez utilizando el método de la formación de sales diastereoméricas, En 1858, August Kekulé propuso que los átomos de carbono estaban tetra-enlazados y años más tarde Jacobus Henricus, Van Hoffy y Joseph Le Bel acuñaron el concepto de carbono tetraédrico. Todo ello llevó a plantear la posibilidad de que dos moléculas de la misma composición fuesen imágenes especulares, lo que coincidía con los datos experimentales. En 1883, William Thomson (Lord Kelvin)propuso el uso del término «quiralidad» que actualmente utilizamos.
Los isómeros ópticos o enantiómeros
Existen tres sistemas diferentes para nombrar y clasificar los enantiómeros de una molécula. El primer sistema de nomenclatura utilizado para identificar la dirección en la que un enantiómero rota el plano de la luz polarizada, es el sistema (+)/(-) o antiguamente y en desuso, d/l. Aquellos que la rotan a la derecha se indican como dextrorrotatorios (+) o d, y aquellos que la rotan a la izquierda son levorrotatorios (-) o l. Una mezcla con igual número de moléculas (equimolecular), 1:1, de los dosenantiómeros (destrorrotatorio + y levorrotatorio -) la denominamos mezcla racémica o racemato, ésta carece de la propiedad de modificar el plano de la luz polarizada, al anularse la respectiva de cada enantiómero con la del otro. La mezcla racémica se nombra como (+)/(-) ó d/l.
Decimos que tenemos un centro/átomoquiral cuando un átomo central está unido a cuatro átomos diferentes (o grupos atómicos) con una geometría tetraédrica. Para nombrar estas moléculas e indicar la posición que ocupan los átomos en el espacio existen dos nomenclaturas: L/D y R/S. Es muy importante tener en cuenta que estas notaciones no tienen ninguna relación con la dirección en que se desvía la luz polarizada, sino con la disposición espacial relativa de los grupos en la molécula.
La nomenclatura L/D -designa con las letras D- y L-, delante del nombre del compuesto-. El sistema D/L, se basa en la comparación con un compuesto de referencia como es el D-gliceraldehído o el aminoácido L-serina. Estas letras proceden de las palabras latinas dextro y levo; el isómero D es el relativo a la molécula que presenta el grupo funcional a la derecha desde el punto de vista del observador, y el isómero L es el que tiene el grupo funcional hacia la izquierda. Ambos isómeros (D)- y (L)- presentan actividad óptica, pero D y L no quiere decir si desvían el plano de la luz polarizada a la derecha o a la izquierda, aunque en algún caso puede coincidir.
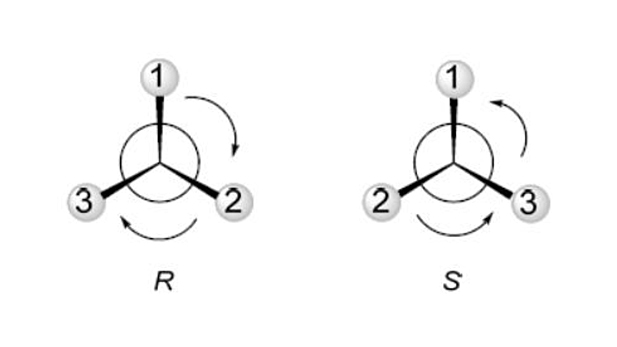
Actualmente los enantiómeros se suelen identificar con una nueva nomenclatura R/S: enantiómero R (de Rectus) y enantiómero S (de Sinister): R y S se asignan siguiendo las reglas de Cahn-Ingold-Prelog, publicadas en 1966, también conocidas por normas CIP. Este sistema está basado en la secuencia en la que se encuentran los átomos o grupos alrededor del centro quiral. Estas reglas establecen la prioridad de los sustituyentes unidos a un átomo, habitualmente carbono: “El orden de prioridad se establece según el número atómico del átomo sustituyente. Un átomo tiene prioridad sobre otros de número atómico menor. Así pues, el hidrógeno es el que tiene una prioridad más baja”.
Si el orden de prioridad de los grupos forma un círculo con sentido acorde a las agujas del reloj, la configuración es R; caso contrario se denomina S (Figura 3).
Isómeros del ácido tartárico
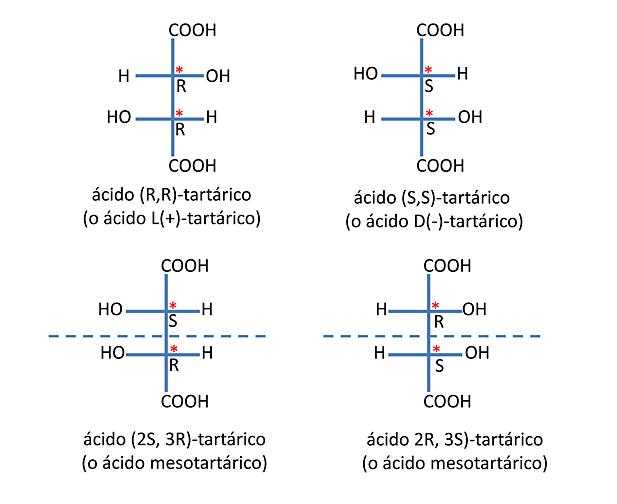
El ácido tartárico (Figura 4) posee dos carbonos asimétricos (marcados con un asterisco en rojo), cada carbono asimétrico es un estereocentro o centro quiral, es decir que cada uno puede tener o bien la configuración R o la configuración S, según las normas CIP.
El ácido (R,R)-tartárico (o ácido L(+)-tartárico) es imagen especular del ácido (S,S)-tartárico (o ácido D(-)-tartárico) y por tanto son enantiómeros entre sí. Diastereoisómero es cada una de las entidades moleculares que se diferencian en uno o más centros quirales. Racemato: compuesto químico que contiene cantidades iguales de un par de enantiómeros. En la figura 4 las dos moléculas superiores son enantiómeros, las dos inferiores son equivalentes (formas meso), tienen centros quirales pero con un plano de simetría por lo que carecen de actividad óptica. Cualquiera de las estructuras superiores es un diastereoisómero de las estructuras inferiores. La mezcla en proporciones iguales (1:1) de las formas enantiomericas forma una mezcla racémica o racémato, que carece de actividad óptica.
La forma que se encuentra en la naturaleza el ácido tartárico es ácido dextrotartárico o ácido L -(+)-tartárico (nombre obsoleto ácido d-tartárico). Los libros de texto modernos y artículos actuales se refieren a la forma natural como ácido (2R, 3R)-tartárico (L-(+)-ácido tartárico), y su enantiómero como (2S, 3S) -ácido tartárico (D-(-)-ácido tartárico). El meso diastereoisómero es el ácido (2R, 3S)-tartárico (que es idéntico al «ácido (2S, 3R)-tartárico».
La Food and Drug Administration de Estados Unidos (FDA), clasificó el ácido L (+) tartárico no sintético y sus sales (es decir, L (+) tartrato ácido de potásico, ácido L (+) tartrato sódico potásico como GRAS. GRAS es un acrónimo del inglés “Generall y Recognized As Safe”, es decir “En general reconocido como seguro”. En 2006, la FDA dictaminó que la forma sintética de ácido L (+) tartárico también se considera GRAS.
El ácido tartárico y sus sales son utilizados como acidulante, controlador del pH, conservante, emulsionante, agente quelante, potenciador y modificador del sabor, estabilizador, agente antiaglomerante y agente reafirmante.
Aparte de su interés en enología, se utiliza en la preparación de productos de panadería y repostería, productos lácteos, aceites y grasas comestibles, conservas de frutas y verduras, productos del mar, productos cárnicos, jugos y refrescos, conservas de azúcar, chicles, cacao en polvo, y bebidas alcohólicas
Importancia de la quilaridad molecular
La quiralidad afecta a todas las interacciones entre las enzimas y sus respectivos sustratos y por tanto tiene enormes consecuencias biológicas. Los enantíomeros pueden tener propiedades totalmente diferentes. Veamos algunos ejemplos.
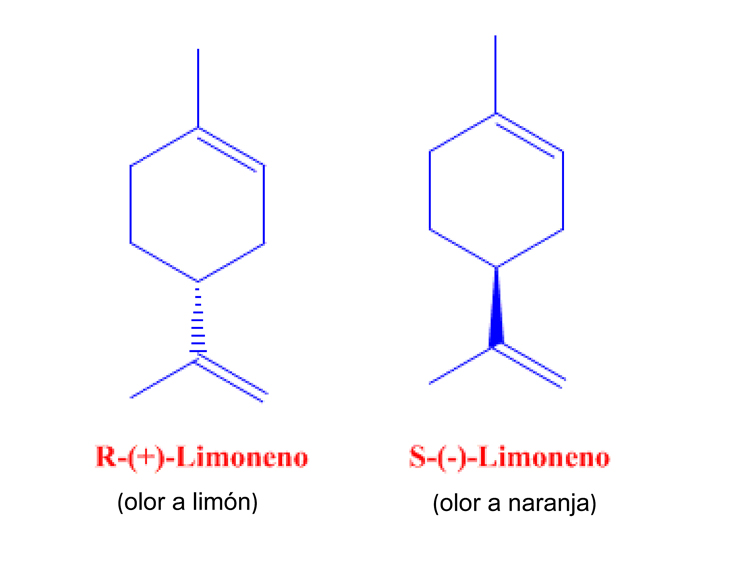
El limoneno que se extrae del aceite de las cáscaras de los cítricos y que da el olor característico a los mismos tiene dos enantiómeros, (Figura 5). El limoneno R (+)de la cáscara del limón tiene el olor característico a limón, en cambio el S (-) de la naranja y le confiere su olor característico a naranja.
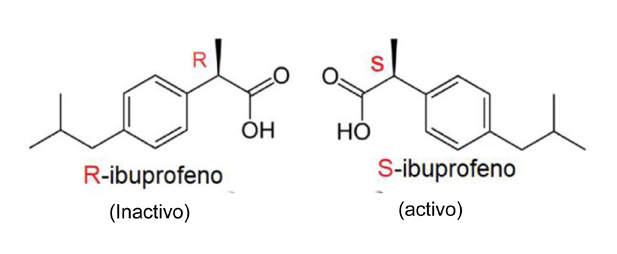
Mayor importancia tiene la quilaridad en las moléculas de los fármacos. Más del 50% de los fármacos que utilizamos son compuestos quirales y la mayoría de veces, sólo uno de sus enantiómeros es biológicamente activo. Este es el caso del popular ibuprofeno, un antiinflamatorio no esteróideo, utilizado frecuentemente para el alivio sintomático de la cefalea, síndrome febril, mialgia, dolores dentales o musculares, (Figura 6). Sólo el enantiómero S del ibuprofeno tiene efecto terapéutico, el enantiómero R es inactivo.
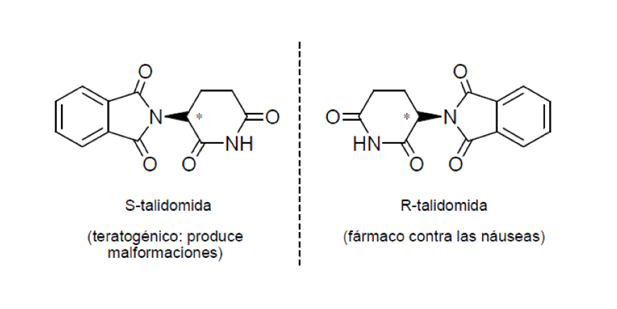
En condiciones fisiológicas normales, ocurre la conversión metabólica de R a S en el hígado, pero es preferible la administración de la forma activa, ya que el funcionamiento hepático depende de las condiciones en que se encuentre el paciente. Este ejemplo es el mejor de los casos, en que uno de los isómeros es inactivo, pero en ocasiones puede resultar incluso muy perjudicial, como ocurrió con la tristemente famosa talidomida. La taladomida actúa como un tranquilizante y analgésico eficaz y tiene un efecto inhibidor de las náuseas en mujeres embarazadas. Este fármaco se comercializó para tal uso entre 1958 y 1963, pero el fármaco era una muestra racémica (moléculas derechas e izquierdas). El enantiómero R de la talidomida tiene esta propiedad beneficiosa, pero el S es teratógeno y produce malformaciones, (Figura 7). Consecuencia de la administración de la mezcla racémica más de 15.000 niños de 46 países nacieron con deformidades de los que actualmente sobreviven menos de 5.000. España fue uno de los últimos países en retirar el medicamento, lo hizo en 1963.
La importancia que tiene la quilaridad, en especial en el diseño y desarrollo de fármacos, quedó reflejada en el hecho que en el año 2001 los doctores William S. Knowles, Ryoji Noyori y K. Barry Sharpless fueran galardonados con el Premio Nobel de Química por sus trabajos en reacciones catalizadas quiralmente, que permiten obtener fácilmente enantiómeros específicos. Conviene no olvidar que todo este conocimiento empezó gracias al tartárico del vino y los trabajos pioneros de Biot y Pasteur.
Fuentes utilizadas:
1.-Alain Sevin. Pasteur and Molecular Chirality, Bibnum [Online],URL :http://journals.openedition.org/bibnum/459
2.- Gal J. The Discovery of Biological Enantioselectivity: Louis Pasteur and the Fermentation of Tartaric Acid, 1857—A Review and Analysis 150 Yr Later. Chirality 2008; 20:5–19.
3.-Morrison JD & Moser HS. Assymetric organic reactions.Prentice-Hall, 1971.
4.-Carey A F&Sundberg RJ.Stereochemistry, conformation and stereoselectivity.En: Advanced Orgranic Chemistry. Springer, USA, Virginia, 2007, p119-250.
5.-Eliel E, Wilen SH, ManderLN. Stereochemistry of organic compounds.Wiley Interscience, 1994.
6.-The Discovery of Enantiomers. https://chem.libretexts.org/@go/page/108672
7.-Geisslinger G, Schuster O, Stock K P et al. Pharmacokinetics of S(+)- and R(-)-ibuprofen in volunteers and first clinical experience of S(+)-ibuprofen in rheumatoid arthritis. Eur. J. Clin. Pharmacol 1990; 38: 493-497.